高二理科化学上学期期中考试试卷
说明:1.本卷满分100分,第I卷60分,第II卷40分,考试时间90分钟。
2.请同学们把答案填写在答题卷上,答在试卷上一律无效。
3.本卷可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 S-32 Cu-64
第I卷(60分)
一、选择题(本大题共有20小题,每小题3分,共60分,每小题只有一个选项符合题意,请把所选的选项填在答题卷上)
1.近年来,光化学烟雾问题已引起人们的注意,造成光化学烟雾的主要物质是( )
A.二氧化硫 B.二氧化氮 C.氨气 D.一氧化碳
2.氨水中所含的分子和离子可能有:①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH—其中正确的组合是( )
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
3. 物质的量浓度、体积均相等的某一元酸和某一元碱相互反应完全,溶液呈( )
A.酸性 B.碱性 C.中性 D.无法判断
4.下列反应的化学方程式中,属于水解反应的是( )
![]()
![]() A.HCO3—+H2O H3O++CO32—
B. HCO3—+H2O H2CO3+OH—
A.HCO3—+H2O H3O++CO32—
B. HCO3—+H2O H2CO3+OH—
C.HCO3—+H3O+ = H2O+CO2↑ D. HCO3—+OH— = CO32—+H2O
5.在无色强酸性溶液中,下列各组离子能大量共存的是( )
A.Na+ 、Fe2+、MnO4—、Cl— B.K+、Fe3+、SCN—、SO42—
C.NH4+、Ca2+、Cl—、NO3— D.Cu2+、Al3+、Cl—、OH—
6.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.1.2g碳中含有碳原子数为1NA
B.1molNaCl中含有离子数为NA
C.7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA
D.1molNH3中电子总数为10NA
7. 当下列溶液的pH值相同时,其物质的量浓度最小的是( )
A.H3PO4 B.HCl C.H2SO4 D.HNO3
![]() 8.
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g) 3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是( )
8.
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g) 3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是( )
A、4molA+2molB+1molD B、6molC+1molD
C、1molA+0.5molB+1.5molC+0.5molD D、2molA+1molB+3molC
9. 在10 mL 0.1mol/L的NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.C(Na+)=c(CH3COO-)+c(CH3COOH) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
10.下列有关中和滴定的叙述中正确的是( )
A.滴定时,标准液的浓度一定越稀越好
B.用盐酸作标准液滴定NaOH溶液时,指示剂加入越多越好
C.滴定管在滴液前和滴液后均有气泡一定不会造成误差
D.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
11.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH = 4K2CO3+10H2O,有关此电池的推断正确的是( )
A.负极反应为14H2O+7O2+28e-= 28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
12. 用H2、C、CO分别与等质量的氧化铁在高温下反应,是氧化铁中的铁全部还原出来,消耗H2、C、CO的质量比为( )
A.1:3:14 B.2:1:2 C.1:1:1 D.1:6:14
![]() 13.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
13.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A. V(O2)=0.01mol.L-1.s-1 B. V(NO)=0.008mol.L-1.s-1
C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1
![]() 14.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,
14.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,
在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的( )
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
15.在反应aMnO4— + bH+ + cCl—= dMn2+ + eCl2↑+ fH2O中b 的值为( )
A.7 B.16 C.14 D.12
16.向20mL2mol/LAlCl3溶液中加入30mLNaOH溶液,充分反应后得到0.78g白色沉淀,则NaOH溶液的物质的量浓度可能为( )
A.1.5 mol/L B. 2mol/L C. 5mol/L D. 8mol/L
![]() 17.对于反应mA(g)+nB(g)
pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )
17.对于反应mA(g)+nB(g)
pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )

A.m+n>p+q,正反应吸热 B. m+n<p+q, 正反应放热
C.m+n>p+q,正反应放热 D. m+n<p+q, 正反应吸热
18. 下列离子方程式正确的是
A.
苏打溶液中滴入少量稀盐酸:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
B. 漂白粉溶液中通入过量CO2:Ca2++ 2ClO-+CO2+H2O=2HClO+ CaCO3↓
C.
三氯化铁溶液中滴入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3![]()
D. 稀硝酸中加入少量铁粉:3Fe+ 4H++2NO3-= 3Fe2++2NO↑+ 2H2O
![]() 19.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是:( )
19.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是:( )
A.单位时间内减少n mol A2,同时生成2n mol AB
B.单位时间内生成n mol B2,同时生成n mol AB
C.单位时间内生成 2xmol AB, 同时生成xmol A2
D.容器内各组成成分的物质的量之和不随时间变化而变化
20. 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( )
A. 68.6% B. 77.8% C. 81.4% D. 无法计算
第II卷(共40分)
二.填空题
21.(4分)铵盐与碱反应均能生成氨气,写出实验室利用此原理制取氨气的反应的化学方程式____________________________;利用相同的发生装置还可制取_______________(填一种气体的分子式),简述如何检验集气瓶氨气是否已收集满了_______________________________。
22.(8分)(1)在25℃条件下将pH=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号)__________;
A.3 B.5 C.2~3之间 D.3~5之间
(2)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是_______ ;
(3)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入 试剂;
(4)常温下,0.1mol·L-1的醋酸和PH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体体积前者比后者 (填“大” ,“小” 或“等”)。
23. (7分)下图中A—G是化合物,H是一种无色气态单质,D常温下是一种无色液体,E是一种淡黄色固体,它们有如下转化关系:
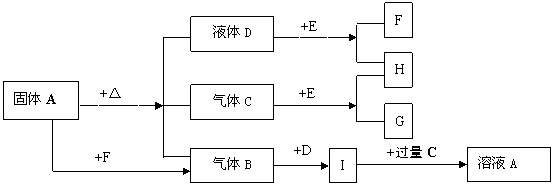
(1)写出A的名称:_________;B分子的空间构型为:____________;
C电子式:____________;
(2)C与E反应的化学方程式:______________________________________;
(3)固体A受热反应的化学方程式:___________________________________。
三.实验题(分)
24.(7分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。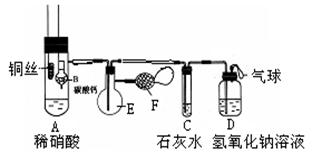
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先排出去其中的空气。你第一步实验操作为:__________________;
确定E中空气已被赶尽的实验现象为:______________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 ;
(3)如何证明E中收集到的是NO而不是H2?
________________________________________________________一段时间后,C中白色沉淀溶解,其原因是_____________ ;
(4)装置D的作用是_____________________________________。
四.计算题(14分)
25.(10分)在某温度下,分别向容积相等的甲、乙两容器中通入0.6molN2O4气体,立即出现红棕色,此反应为吸热反应。反应过程中,甲容器保持体积不变,乙容器保持压强不变。乙容器达到平衡时,混合气体中各物质的物质的量相等。请回答下列问题:
(1)容器中气体出现红棕色的原因是(用化学方程式表示)___________________;
(2)反应达到平衡时,两容器中所需要的时间:甲______乙(填“大于”、“小于”或“等于”);
(3)乙容器中反应达到平衡时,N2O4的转化率是_______________;
(4)若使甲、乙两容器中反应达到平衡时,N2O4的浓度相等,不能采取的措施是(填序号)_____;
A.保持温度不变,适当压缩乙容器的体积
B.保持容器体积不变,适当升高甲容器的温度
C.保持容器体积不变,向甲容器中通入适量的N2O4
(5)若保持温度不变,乙容器起始时NO2的物质的量为0.4mol,达到平衡时,NO2的物质的量为0.8mol,混合气体中各物质的物质的量仍相等,则起始时容器中N2O4物质的量为________________;
26.(4分)氨氧化法制硝酸的生产过程中,如果由氨制一氧化氮的转化率为96% ,而一氧化氮转化为硝酸的转化率为92% 。现用10 t 氨按上述情况可制得50%的硝酸多少吨?
高二化学参考答案
一.选择题(每题只有一个正确答案每小题3分,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | D | D | B | C | D | C | A | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | D | C | B | C | C | C | C | C |
二.填空题(共3小题,19分)
21.2NH4Cl + Ca(OH)2 == CaCl2 + 2NH3↑+ 2H2O(2分); O2(1分);
把湿润的红色石蕊试纸放在集气瓶口,若试纸变为蓝色说明氨气已收集满(1分)。
22、(1)D (2分) (2)醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小(2分)
减小(2分)
(3)醋酸钠 (2分)(4)小(2分)
23、(1)碳酸氢铵(1分);三角锥形(1分);![]() (1分)。
(1分)。
(2)2CO2 + 2Na2O2 = 2Na2CO3 + O2 (2分)。
(3)NH4HCO3 == NH3↑ + H2O + CO2↑(2分)。
三.实验题(共一小题,7分)
24、(1)放下B使碳酸钙和硝酸反应(1分)
有白色沉淀产生(1分)
(2)3Cu+8 H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)鼓入空气变红棕色(1分)、 生成硝酸 (1分)
(4)尾气吸收(1分)
四.计算题(共两小题,14分)
25、(1)N2O4![]() 2NO2
(2分);
2NO2
(2分);
(2)小于(2分); (3)33.3%(2分);
(4)C(2分);
(5)1mol(2分)。
26、65(t)(4分)