高二理科化学下学期期中试题
高二化学试题(理科)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,时间90分钟,
能用到的相对原子质量: H:1 S:32 Na:23 O:16 AI:27 Fe:56 N:14 Ba:137
第I卷(选择题50分)
一、选择题(共10小题,每小题2分,共20分;每小题只有一个选项符合题意)
1.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。这种试剂是
A .NH3×H2O B .NaOH C.Na2CO3 D.MgCO3.
2.下面不能由单质直接化合而得到的化合物是
A. FeCl2 B. Al2S3 C. FeS D. Fe3O4
3.随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
4.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)<c(H+) B.c(HX)>c(X-)
C.c(X-)+c(HX)=2c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-)
5.反应 2A(g) + B(g)![]() 2C(g);△H > 0 。下列反应有利于生成C的是:
2C(g);△H > 0 。下列反应有利于生成C的是:
A. 低温、低压 B. 低温、高压 C. 高温、高压 D. 高温、低压
6.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]()
Z(g)+W(s);ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
7.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为: 4Al+3O2+6H2O=
4Al(OH)3,下列说法不正确的是
A.正极反应为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
8.pH=9 的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1)
A.![]() ×(4×10-9+1×10-12)
B.
×(4×10-9+1×10-12)
B.![]() ×(8×10-9+1×10-12)
×(8×10-9+1×10-12)
C.5×10-10 D.5×10-12
9.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
10.下列有关滴定操作的正确顺序是:
(1)用标准溶液润洗滴定管 (2)往滴定管内注入标准溶液 (3)检查滴定管是否漏水 (4)滴定 (5)洗涤
A、(3)(1)(2)(4)(5) B、(3)(5)(1)(2)(4)
C、(3)(5)(2)(4)(1) D、(5)(1)(2)(4)(3)
二、选择题(共10小题,每小题3分,共20分;每小题只有一个选项符合题意)
11.温度相同、浓度均为0.2 mol L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤CH3COONa溶液,它们的pH值由小到大的排列顺序是
A.③①④②⑤ B.①③④②⑤ C.③②①④⑤ D.⑤②④①③
12.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
13.浓度均为0.1mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是:
A.BaCl2 NaOH NaHCO3 B.Na2CO3 MgCl2 H2SO4
C.AlCl3 NH3·H2O NaOH D.Ba(OH)2 CaCl2 Na2SO4
14.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1mol铜与足量硫充分反应后转移的电子数为2NA
B.100mL 0.5mol·L-1乙酸溶液中含乙酸分子数为0.05NA
C.常温常压下,31g白磷分子中的共价键数为6NA
D.标准状况下,2.24L二氧化碳与二氧化硫的混合气体中所含分子数为0.1NA
15.下列离子方程式中,书写正确的是
A.铝片和氢氧化钠溶液反应: Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应: SO4-+Ba+=BaSO4↓
C.硝酸亚铁溶液中加入少量的盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
D.Fe2(SO4)3的酸性溶液中通入足量硫化氢 Fe3++H2S=Fe2++S↓+2H+
16.常温下,某水溶液中含有的离子浓度为c(Na+)=xmol/L、c(SO42-)=0.15mol/L、c(K+)=0.2mol/L、c(Cl-)=0.45mol/L、c(Mg2+)=0.25mol/L、c(NO3-) =0.25mol/L、c(OH-)=10-13mol/L.则x值为
A.0.2 B.0.3 C.0.4 D.0.1
17.由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是
A.锌 B.铁 C.铝 D.镁
18、原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:
Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
19.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比![]() 的关系如图所示,则X,Y的反应方程式可表示为
的关系如图所示,则X,Y的反应方程式可表示为
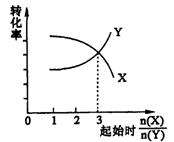
A.2X+Y![]() 3Z B.3X+2Y
3Z B.3X+2Y![]() 2Z C.X+3Y
2Z C.X+3Y![]() Z D.3X+Y
Z D.3X+Y![]() Z
Z
20.镁条在空气中燃烧生成氧化镁和氮化镁。将燃烧后的产物溶解在50mL 2.0mol/L的盐酸中,再用20mL0.5mol/L烧碱溶液中和多余的盐酸,然后在此溶液中加过量的碱,把氨全部蒸出来,用稀盐酸吸收,稀盐酸增重0.17g。镁条的质量为
A.0.24g B.0.48g C.0.72g D.0.96g
高二化学答题卡(理科)
第I卷(选择题50分)
一、二、选择题(共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题50分)
三、填空题(共3小题,共30分)
21.(12分)
(1)氢氧化铝具有两性其电离方程式可表示为
____________________________________________________ _。
(2)表面带有氧化膜的铝片放入适量的烧碱溶液中观察到的现象是:
______________________________________________________ ;
反应方程式为:
_____________________ _。
(3)写出用氧化铝、三氧化二铬制金属铬(Cr)的化学方程式:(不得用其
它原料)
______________________________________________________________。
22.(8分)在一个1L的密闭容器中加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。
3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。
(1)维持容器的温度不变,若缩小容器的体积,则平衡______ __移动(填“向正反应方向”、“向逆反应方向”或“不”)
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,
C的浓度仍是1.2mol/L的是______ __。
A. 4molA+2molB B. 3molC+1molD
C. 2molA+1molB+1molD D. 1molA+0.5molB+1.5molC+0.2molD
(3)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的
条件是______________ _____。
23.(10分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]() H2B
H2B H+ + HB– HB–
H+ + B2–
回答下列问题:
(1)Na2B溶液显_________(填“酸性”,“中性”,或“碱性”)。理由是
_________________ _(用离子方程式表示)。
(2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是__________。
A.c (B2– ) + c (HB– ) + c (H2B) = 0.1 mol/L
B.c (Na+ ) + c (OH– ) = c (H+) + c (HB– )
C.c (Na+ ) + c (H+ ) = c (OH – ) + c (HB– ) + 2c (B2 – )
D.c (Na+ ) = 2c (B 2– ) + 2c (HB– )
(3)已知0.1 mol/L NaHB溶液的pH =2,则0.1 mol/LH2B溶液中氢离子的物质的量浓度可能是_________0.11 mol/L(填“<”,“>”,或“=”),理由是:
________________________ _。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序
_________________ 。
四、实验题(共1小题,共14分)
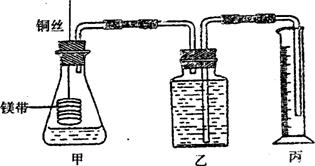 24.(14分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:
24.(14分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:
①配制浓度均为0.5mol/L H2SO4和H2C2O4溶液;
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值至少为 ;
④检查装置的气密性,在广口瓶中装满水,按图连接好装置;
⑤将铜丝向下移动,使足量镁带浸人酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后,读取量筒内水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g·cm-3,98%的浓H2SO4配制浓度为0.5mol/L的H2SO4溶液,所需要的仪器为 。
(2)用文字表述④检查装置气密性的操作与观察方法:
。
(3)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积。这三步操作的正确顺序是 。
(4)读取量筒内水的体积时,若丙中液面高于乙中液面,如何使乙、丙中液面相平? 。
(5)本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(6)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm= 。
(7)简述速率不等的原因 ,
铜丝不与酸接触的原因是
。
五、计算题(共1小题,共6分)
25.(6分)将镁铝的固体混合物0.1mol溶于100ml 2mol·L-1稀硫酸中充分反应后固体全部溶解,然后再向反应后的混合溶液中滴加1mol·L-1NaOH溶液。
(1)若在滴加NaOH溶液过程中,使Mg2+、Al3+全部生成沉淀,则滴入的NaOH溶液体积是 ml。
(2)设0.1mol镁铝固体混合物中Mg的物质的量分数为a,若在滴加Na0H溶液450ml后,所得沉淀只有Mg(OH)2,则a的取值范围是 。
高二化学参考答案(理科)
第I卷(选择题50分)
一、二、选择题(共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | C | A | C | B | B | D | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | A | B | D | C | A | C | C | D | D |
第II卷(非选择题50分)
三、填空题(共3小题,共30分)
21.(12分)
(1)H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH-(2分)
Al3++3OH-(2分)
(2)开始没有气体产生,后来产生气体并加快,一段时间后又减慢,最后反应停止;(2分)
Al2O3+2NaOH===2NaAlO2+H2O(2分)
2H2O+2Al+2NaOH===2NaAlO2+H2↑(2 分)
|
| ||||
(3)2Al2O3==== 4Al+3O2↑(2分);2Al+Cr2O3======Al2O3+2Cr(2分)
22.(8分)
(1) 不 (2分)(2) BCD (3分) (3)大于0.6 mol(3分)
23.(10分)
(1)碱性 (1分) B2– + H2O![]() HB – + OH –(2分)
HB – + OH –(2分)
(2)CD(2分)
(3)<,(1分)H2B第一步电离产生的H+,抑制了HB – 的电离(2分)
(4)c (Na+) > c (HB – ) > c (H+) > c (B2– ) > c (OH – ) (2分)
四、实验题(共1小题,共14分)
24.(14分)
②酸式滴定管 (1分) ③0.12 (1分) ⑤反应起止时间(1分)
(1)量筒,烧杯,玻璃棒,容量瓶,胶头滴管(2分)(少一个给1分, 少两个不给分)
(2)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(2分)
(3) .②①③ (1分)
(4)将量筒缓缓向下移动,使乙、丙中液面相平(1分)
(5)B (1分)
(6)0.2VL/mol(2分)
(7)酸的浓度相同时c(H+)不同 , (1分) 防止形成原电池,干扰实验现象的观察(1分)
五、计算题(共1小题,共6分)
25.(6分)
(1)400 (2分)
(2)0.5≤a<1(4分)