高二级化学学业水平测试
考前提醒
选择题只有一个选项正确,选做题选《化学与生活》
1、计算结果要写单位:摩尔质量g·mol-1、摩尔体积L·mol-1、物质的量浓度mol·L-1
标准状况下气体摩尔体积:22.4 L·mol-1。
2、看清要求回答什么:是物质的质量还是物质的量;是要求写出物质名称还是物质化学式;要求写分子式、电子式还是结构简式;要求写离子方程式、电极反应还是化学反应方程式;要求写出生成物的结构简式、反应类型还是反应方程式;
3、特别注意括号中的要求:要求填“偏大”、“偏小”就不能填“变大”“增大”等。
4、计算题解答书写要条理工整,用原始数据、带单位进行计算,若使用未知数要先假设。建议大家尽量分步列式计算,因评分标准往往是分步给分的,答案单独写一行。
5、化学反应方程式要写上应有的条件和符号如“↑”“↓”等
![]() 6、用电子式表示物质的形成过程和有机化学方程式用“→”,无机化学方程式用 “=”,注意写出反应条件。酯化反应的生成物不能漏写“水”。
6、用电子式表示物质的形成过程和有机化学方程式用“→”,无机化学方程式用 “=”,注意写出反应条件。酯化反应的生成物不能漏写“水”。
7、注意不能写错别字:羧基(-COOH)、羟基(-OH)、醛基(-CHO);苯( );氨基(—NH2、H2N—);硝基(—NO2、O2N—);萃取、分液、蒸馏;油脂(高级脂肪酸的甘油酯)、酯化反应、加成反应;氨气、铵盐、(气体)逸出、(液体)溢出;褪色、溶解、熔点、熔融;炭化、褪色、钝化、气体逸出、金刚石、铵盐。
第三周期IVA族;书写电子式时,共价化合物不能忘了未成对电子,离子化合物中的阴离子与原子团离子不能忘了加中括号,离子化合物的形成过程要标出电子的转移方向。
8、常见物质的颜色:酸性KMnO4溶液紫色;碘遇淀粉变蓝色;蛋白质遇浓HNO3显黄色; NO2和Br2蒸气为红棕色气体;无色气体遇空气变为红棕色气体是NO;
红棕色粉末状固体:Fe2O3;红褐色沉淀:Fe(OH)3;白色沉淀:Fe(OH)2
血红色溶液:Fe(SCN)3;Fe3+溶液为黄色;Fe2+溶液为浅绿色;Cu2O为砖红色; 溴
水为橙色;品红试液(红色)中通SO2、Cl2均褪色;对褪色后的溶液再加热,红色恢
复的是SO2; Na2O2为淡黄色固体
考 试 时 的 应 对 策 略
冷静思考,细心审题,精确运算,规范作答
1.仔细、仔细、再仔细:即在浏览、审题、解答等各个环节中,都保持高度的仔细,聚精会神,一丝不苟。遇到难题不惊慌,碰到容易的题不大意,做过的题注意题目是否有变化。
2.审题、审题、细审题:审题是正确解题的关键,考试时你必须认真审题,看清楚题目条件和要求,按要求回答问题。
3.质量、质量、高质量:即你在考试过程中要始终保持质量意识,不放弃任何一道自己会做的试题,不做错任何一道会做的试题,这就是你的解题质量意识。
预祝同学们
在考试中取得优异成绩!
1.甲、乙、丙、丁是四种短周期元素,乙原子有三个电子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
⑴ 甲是 元素(填元素符号),甲的单质与水反应的离子方程式为 ;
⑵ 乙是 元素(填元素符号),原子结构示意图为 ;
⑶ 丙是 元素(填元素名称),最高价氧化物对应水化物的化学式是 ;
⑷ 丁是 元素(填元素名称),甲与丁两种元素可组成的物质有 、 。(填化学式)
![]() 2.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
2.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表示该物质的一个重要应用 。
(3)若C是红棕色气体,则A的化学式可能为 ,试写出C与水反应的化学方程式 。
⑷若A为无色有特殊香味的液体,写出A与C反应的化学方程式 。
3.某校高一研究性学习小组将造成我省某市空气污染的主要原因分以下四种:
A.燃烧农作物秸秆 B.燃烧含硫煤
C.粉尘污染 D.机动车尾气污染
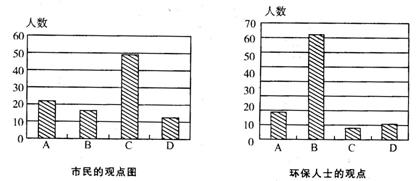 并就造成该市空气污染的是主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
并就造成该市空气污染的是主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
(1)调查结果显示:该市市民认为造成空气污染的最主要原因是 ,环保人士认为造成该市空气污染的最主要原因是 。(填序号)
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是 。
当空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为 。
(3)下列措施中能够减少该成分排放量的是 。
①用天然气代替煤炭做民用燃料 ②植树造林
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
⑤在已经酸化的土壤中加生石灰 ⑥使用电动车
4.下图是铜与浓硫反应的实验装置图,请回答下列问题:
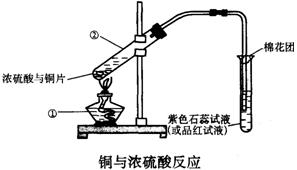
(1)写出仪器的名称:① ②
(2)写出铜与浓硫酸反应的化学方程式并标出电子转移的方程和数目,其中浓硫酸的作用是
A.氧化性 B.酸性 C.吸水性 D. 脱水性
(3)将产生的气体通入品红溶液中的现象为
5.乙烯是重要的化工原料,被称为“石化工业之母”,中国乙烯工业总体水平已步入世界先进国家行列。
(1)目前,生产乙烯的主要途径是从 中获得,乙烯分子的电子式为 。
(2)乙酸乙酯是一种常见的有机溶剂,某同学设计了一个以乙烯为原料合成乙酸乙酯的方案,该方案包含加成反应、氧化反应、酯化反应等反应类型,其化学方程式如下,请你协助他补充完整:
① ;
② ;
![]()
③
④ 。
6.下面是某同学研究氯水漂白性的一个探究性实验片断。
活 动 记 录
[观察]氯气的颜色:黄绿色;氯水的颜色:呈黄绿色。
[结论]氯水中含有氯气。
[实验操作]用两根玻璃棒分别蘸取盐酸和氯水,各滴在两片蓝色石蕊试纸上。
[实验现象]滴有盐酸的试纸变红,滴有氯水的试纸上间变白,外圈变红。
[分析与结论]氯水呈黄绿色,说明氯水中溶有游离的氯气。滴有氯水的蓝色石蕊试纸外圈变红,说明氯水中有能使试纸变红的酸生成;中间变白,说明氯水中有能够使有色物质褪色的物质生成。
[问题与思考]氯气溶于水发生如下反应:Cl2+H2O=HCl+HClO,溶液中的水和盐酸都没有漂白作用,能够使有色物质褪色的物质是氯水中的氯气还是氯水中的次氯酸呢?还是二者都有漂白作用?
请你参照他已完成的部分实验活动记录,自己设计一个实验,证明到底是哪种物质有漂白作用。
[实验操作]
。
[可能的实验现象]
。
[分析与结论]
。
7.取2.14gNa2CO3·xH2O溶于水配成10mL溶液,然后逐渐滴入稀H2SO4,直至没有气体反应为止,用去硫酸2.0mL,并收集到224mLCO2(标准状况),
求:(1)稀硫酸的物质的量浓度;
(2) Na2CO3·xH2O的摩尔质量;
(3)x的值。
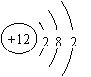
【参考答案】
1. ⑴ Na 2Na+2H2O=2NaOH+H2↑ ⑵ Mg ⑶ 碳 H2CO3 ⑷ 氧 Na2O Na2O2
2.(1)2SO2+O2![]() 2SO3(条件为催化剂、加热)
2SO3(条件为催化剂、加热)
(2) 过氧化钠 2Na2O2+2CO2=2Na2CO3+O2
(3)N2或NH3 3NO2+H2O=2HNO3+NO
⑷CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O (条件为浓硫酸、加热)
CH3COOCH2CH3+H2O (条件为浓硫酸、加热)
3.(1)C B (2)SO2 2SO2+O2+2H2O===2H2SO4 (3)①④⑥
![]() 4.(1)酒精灯
试管
4.(1)酒精灯
试管
(2)Cu+2H2SO4===CuSO4+SO2↑+2H2O
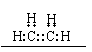 (2)A B (3)品红溶液褪色
(2)A B (3)品红溶液褪色
5.(1) 石油中
|
![]() (2)①CH2=CH2+H2O CH3CH2OH
(2)①CH2=CH2+H2O CH3CH2OH
②CH3CH2OH+O2 2CH3CHO+2H2O
|
![]() ④CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
④CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
6.先将氯气通过浓硫酸的洗气瓶,再通过盛有干燥的有色布条的空洗气瓶,接着通过盛有湿润的有色布条的洗气瓶;干燥的有色布条不褪色,湿润的有色布条很快褪色;干燥的有色布条不褪色,说明Cl2没有漂白性;湿润的有色布条褪色,说明HClO有漂白性
7. Na2CO3+H2SO4==Na2SO4+CO2↑+H2O
0.01mol 0.01mol 0.224L
(1) c(H2SO4)=5mol/L
(2) M(Na2CO3)=214g/mol
(3) x=6