高二化学X科下学期期中考试试卷
第Ⅰ卷(选择题 共70分)
可能用到的原子量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Si:28 P:31 S:32 Cl:35.5
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.能用酸性高锰酸钾溶液鉴别的一组物质是
A.乙烯 乙炔
B.苯 己烷
C.己烷 环己烷
D.苯 甲苯
2.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl
C.Cl2 D.F2
3.下列说法不正确的是
A. 乙二醇和丙三醇为同系物
B.正戊烷、异戊烷、新戊烷的沸点逐渐降低
C.CH3—CH=CH2和CH2=CH2的最简式相同
D.CH≡CH和C6H6含碳量相同
4.下列说法不正确的是
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
5. 下列物质中,在一定条件下,既能发生消去反应,又能发生水解反应的是
A.一氯甲烷 B.乙醇
C.溴乙烷
D.![]()
6.下列物质中,含极性键和非极性键且分子有极性的是
A.乙烯 B.乙醛 C.甲醇 D.三氯甲烷
7.下列说法正确的是
A.含有羟基的有机物称为醇
B.能发生银镜反应的有机物都是醛
C.苯酚俗称石炭酸,酸性比碳酸强
D.甲酸除了具有羧酸的性质之外,也具有醛的一些性质
8.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
9.下列四种烃的名称所表示的物质,命名正确的是
A.2—甲基—2—丁烯
B.2—乙基丙烷
C.3—甲基—2—丁烯
D.2,2-二甲基-3-戊炔
10. 若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子
B.该元素原子最外层共有3个电子
C.该元素原子核外有5个电子层
D.该元素原子M能层共有8个电子
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
11. 下列叙述正确的是
A.植物油不能使溴的四氯化碳溶液褪色
B.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
C.葡萄糖能发生氧化反应和水解反应
D.淀粉水解的最终产物是葡萄糖
12. 下列分子中杂化轨道类型错误的是
A.乙烯中C原子为sp2杂化
B.水分子中O原子为sp2杂化
C.NH3中N原子为sp3杂化
D.BF3中B原子为sp3杂化
13.乙炔、苯和乙醛的混合物中碳的质量分数为72%,则氧元素的质量分数为
A.22% B.19.6% C.8.8% D.4.4%
14. 下列关于丙烯(CH3—CH =CH2)的说法正确的是
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
15.右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
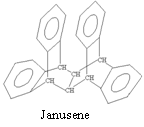 A.Janusene的分子式为C30H20
A.Janusene的分子式为C30H20
B.Janusene既可发生氧化反应,又可发生还原反应
C.Janusene苯环上的一氯代物有8种
D.Janusene属于苯的同系物
16.下列物质不属于等电子体一组的是
A.SO3和NO3- B.B3N3H6和C6H6
C.CO2和N2O D.H2O和CH4
17.2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明的“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在氢核磁共振谱中只给出一种信号的是
A.HCHO
B.![]()
C.HCOOH
D.CH3OCOOCH3
18.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+ m,则X的最高正价一定为+ m
19.“魔棒”常被用于晚会现场气氛的渲染。其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为: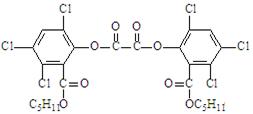
下列有关说法不正确的是
A.草酸二酯属于芳香族化合物
B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水
D.1mol草酸二酯最多可与4molNaOH反应
20.A和M为两种元素,已知A位于短周期,且A2—与M+的电子数之差为8,则下列说法中正确的是
A.A和M的原子序数之差为8
B.A和M原子的电子总数之和可能是11
C.A和M原子的最外层电子数之和为8
D.A和M原子的最外层电子数之差为5
第Ⅱ卷(非选择题 共80分)
三、(本题包括3小题,共20分)
21.(8分)
(1)(3分)下列有机实验操作或叙述正确的是_____________(填写代号,多选扣分)
A、将铁屑、溴水、苯充分混合即可制取溴苯
B、在96%酒精水溶液中加新制生石灰后蒸馏可制无水酒精
C、只用水就能鉴别苯、硝基苯、乙醇
D、用分液漏斗可以将溴苯和水的混合物分离,用NaOH溶液可以除去溴苯中溶有的Br2
E、制取硝基苯的操作为:大试管中先加入浓硫酸,再加浓硝酸,冷却至60℃以下,再逐滴加入苯,放入沸水浴中加热
(2)(5分)用价层电子对互斥理论(VSEPR)判断下列分子的空间构型
| 分子 | HCN | XeF4 | SF6 | BF3 | CH4 |
| 空间构型 |
|
|
|
22.(6分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2中D与B的质量比为7:8;在EB2中E与B的质量比为1:1。试回答:
(1)写出D原子的电子排布式──────────────── 。
(2)用电子式表示AE2的形成过程━━━━━━━━━━━━━━━━━━━━
(3)B、C两元素的第一电离能大小关系为:───>────(填写元素符号),原因是───────────────────────────────────── 。
23.(6分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构型为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
四、(本题包括4小题,共39分)
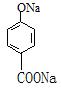
24.(10分)尼泊金酸的结构简式为: ![]()
(1)尼泊金酸的分子式为________________________。
(2) 1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a. 4 mol H2 b. 2 mol NaHCO3 c. 2 mol Br2 d. 2 mol Na2CO3
(3)将尼泊金酸与足量NaOH溶液混合后反应,生成的有机物结构简式为_________________。
(4)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式(各写一种):
ⅰ酯类 ;ⅱ醛类 。
25.(9分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。
下表是一些键能数据。(单位:KJ·mol-1)
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH= —QKJ/ mol;通过计算确定热化学方程式中Q的值为 。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是 。
(4)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释: 。
(5)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)
②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。能否从数据找出一些规律,请写出一条: 。
26.(10分)下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A为无水乙醇(沸点为78℃),B为螺旋状的细铜丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
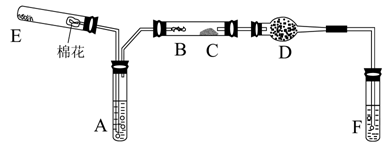
(1) 在上述装置中,实验时需要加热的仪器有(填仪器某部位的代号) ,E处是一种纯净物,其发生反应的化学方程式为 。
(2) 为使A中乙醇平稳地气化成乙醇蒸气,可采取的措施是 。D处使用碱石灰的作用是 。
(3) 能证明乙醇的反应产物的实验现象是 。
(4) 本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,推断B处发生反应的化学方程式 。
27.(10分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 。(写一个即可)
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
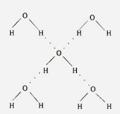 (4)在冰晶体中,每个水分子与相邻的4个水分子
(4)在冰晶体中,每个水分子与相邻的4个水分子
形成氢键(如图所示),已知冰的升华热是51 kJ/mol,
除氢键外,水分子间还存在范德华力(11 kJ/mol),
则冰晶体中氢键的键能是 kJ/mol。
(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子。请写出生成此配合离子的离子方程式: 。
五、(本题包括2小题,共21分)
28.(7分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素。
(2) 现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
试推断紫色晶体的化学式为 。
29.(14分)已知:
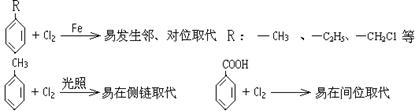
某有机物A的相对分子质量为198.5,A跟氯气反应,在铁粉存在下只有一个氢原子被取代时能得到两种有机产物,而在光照下只有一个氢原子被取代时,只能得到一种有机产物;A跟NaHCO3反应,产生使石灰水变浑浊的无色气体;A在NaOH存在下水解后的溶液用硝酸酸化,再加入硝酸银溶液,会立即生成白色沉淀。
A在一定条件下可发生下列一系列反应,最终生成D和F;
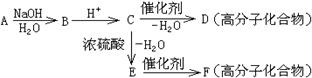 (1)写出下列物质的结构简式:
(1)写出下列物质的结构简式:
A: C: D: F:
(2)指出下列变化的反应类型:①A→B: ②C→D:
③C→E:
高二化学X科评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | A | D | C | B | D | B | A | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | BD | B | AC | B | D | AD | A | BD | BD |
21.(8分)(1) (3分) BCD
(2)(5分)(每空1分)
| 分子 | HCN | XeF4 | SF6 | BF3 | CH4 |
| 空间构型 | 直线形 | 平面正方 | 正八面体 | 平面三角形 | 正四面体 |
22. (6分)
(1)1s22s22p63s23p2 (1分)
(2) (1分)
![]()
(3) N, (1分)O, (1分) N原子中最外层电子处于半充满状态,比较稳定(2分)
23.(6分)
(1)⑨ (1分) (2)苯 (1分)(3) 1 (1分) 三角锥形 (1分)
(4) Be(OH)2+2NaOH=Na2BeO2+2H2O (2分)
24. (10分)
(1)C7H6O3(1分) (2)c、d(2分);
 (3)
(2分)
(3)
(2分)
(4) ⅰ: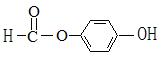 (邻,间等)(2分)
(邻,间等)(2分)
ⅱ: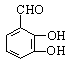 (2分)。
(2分)。
25.(9分)(1)小于 (1分) 218~330 KJ·mol-1 (1分)
(2)185 (1分)
(3)RI> RBr > RCl > RF(1分)
(4)不赞同,H2O的熔沸点高于H2S是因为水分子间存在氢键,与键能无关。(2分)
(5)①不能 (1分) ②不能 (1分) 与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强。(1分)
26. (10分)
(1) ABFE(2分); 2KMnO4![]() K2MnO4+MnO2+O2↑
(2分)
K2MnO4+MnO2+O2↑
(2分)
(2) 往A中加入少量碎瓷片,并采用水浴加热(1分) 防止F中的水蒸汽进入硬质玻璃管中,影响C的颜色变化(1分)
(3) F中有砖红色沉淀产生,C物质变蓝(2分)
(4)CH3CH2OH![]() CH3CHO+H2(2分)
CH3CHO+H2(2分)
27(10分)(1)1S22S22P4;(2分)(2)H2S或NH2-;(2分)(3)A;(2分)(4)20;(2分) (5)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
28. (7分)
(1) 四(1分) IVB族(1分)
1s2 2s2 2p6 3s2 3p6 3d2 4s2(或[Ar]3d2 4s2(2分) d(1分)
(2)[ Ti(H2O)6]Cl3 (2分)
29.(14分)
(1)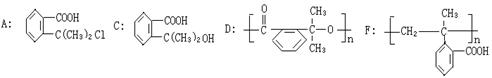 (各2分)
(各2分)
(2)①水解(或取代) ②缩聚 ③消去(各2分)