高一化学上学期期末调研考试
化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分120分。考试时间90分钟。
第一卷(选择题 共48分)
注意事项:
1.回答第I卷前,考生务必在答题卡姓名栏内写上自己的姓名、考试科目、准考证号,并用2B铅笔涂写在答题卡上。每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
2.回答第Ⅱ卷前,考生务必在答题纸密封线内写上自己的姓名和准考证号,Ⅱ卷的答题内容应填写在答题纸的相应位置上。
3.第I卷和第Ⅱ卷答案写在试卷上无效。考试结束后,将答题卡和答题纸一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al—27 S-32
Cl-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
 1.2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔的主要贡献是研究气相物质与固相物质表面发生反应的化学原理,开创了表面化学的先河。以下问题或事实与表面化学无关的是
1.2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔的主要贡献是研究气相物质与固相物质表面发生反应的化学原理,开创了表面化学的先河。以下问题或事实与表面化学无关的是
A.铁在潮湿的空气中容易生锈的原理研究
B.铁作为催化剂采用氮气和氢气反应合成氨
C.CO与NO在催化剂存在时生成CO2和N2
D.CuSO4溶液中加入BaCl2溶液时产生白色沉淀
2.硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。下列物品用到硅单质的是
A.玻璃制品 B.石英钟表 C.计算机芯片 D.光导纤维
3.近20年来,同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.1H216O比1H218O的摩尔质量小
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
4.某实验小组通过实验证明了海水中确实存在碘元素,并获得了一定量的碘水。现欲从碘水中进一步提取碘首先需要
A.萃取 B.沉淀 C.蒸馏 D.过滤
5.研究发现,NO在人体的血管系统内具有传送信号的功能,因而有“信使分子”誉称。则下列有关NO的说法正确的是
A.NO不属于大气污染物 B.NO能溶于水
C.NO易与空气中氧气化合 D.NO可用排空气法收集
6.在无色透明的溶液中可以大量共存的离子组是
A.H+、K+、ClO-、NO3- B.OH-、Cl-、Na+、NH4+
C.Cu2+、NO3-、OH-、Cl- D.Mg2+、K+、Cl-、NO3-
7.依据一定的标准采取不同的分类方法是人们认识事物常用的方法。下列有关物质类别的判别标准中,正确的是
A.酸:能否与金属反应放出氢气 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.酸性氧化物:能否与碱反应
8.下列物质的鉴别方法不正确的是
A.用焰色反应鉴别NaCl溶液和Na2SO4溶液
B.用品红试液鉴别SO2和CO2两种气体
C.用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液
D.利用丁达尔效应鉴别淀粉胶体和蒸馏水
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.1.7g的氢氧根离子中含有的电子数为6.02×1022
B.在标准状况下,2.24LSiO2中所含分子数为6.02×1023
C.500mL1.0mol·L-1的Na2SO4溶液中,阴、阳离子总数为6.02×1023
D.1.2g金属镁变为镁离子时失去的电子数为6.02×1022
10.以下物质间的每步转化通过一步反应能实现的是
A.Al-Al2O3-Al(OH)3-NaAlO2 B.Fe-FeCl2-Fe(OH)2-Fe(OH)3
C.N2-NO-NO2-HNO3 D.S-SO3-H2SO4-MgSO4
11.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4和KCl。下列关于①和②的说法正确的是
A. 都属于氧化还原反应
B. 发生还原反应的元素不同
C. 发生氧化反应的元素相同
D. 生成KCl的物质的量不等
12.对经常出现的客观现象进行归纳可以形成普遍规律,但普遍规律也存在特殊性,寻找例外现象出现的原因是科学发展的内在动力。下列事实与括号内相关规律不相吻合的是
A.Cs是很活泼的金属(碱金属具有很强的金属性)
B.Cl是同周期中原子半径最小的元素(同一周期原子半径依次减小)
C.Al在常温下遇浓硫酸钝化(活泼金属与浓硫酸有气体产生)
D.HF是所有卤化氢中最稳定的物质(非金属越强,其气态氢化物越稳定)
13.下列离子方程式书写正确的是
A.用大理石和稀盐酸制取二氧化碳:2H+ +CO32-=CO2 ↑+H2O
B.钠投入水中:2Na+2H2O=2Na++2OH-+H2 ↑
C.氧化铝与氢氧化钠反应:Al2O3+OH-=AlO2-+H2O
D.向稀硝酸溶液中加入过量的铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
14.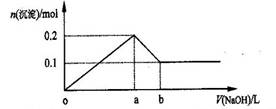 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断不正确的是
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断不正确的是
A.混合溶液中Al3+的物质的量为0.1mol
B.NaOH的浓度为0.6 mol/L
C.在b点处溶液中的溶质只有NaAlO2 D.图中线段oa : ab=5 : 1
第二卷(非选择题 共72分)
三、(本题包括2小题,共24分)
15.(10分)现用18.4mol/L的浓硫酸配制500mL0.2mol/L的稀硫酸。可供选用的仪器有:
① 玻璃棒 ②量筒 ③ 烧杯 ④ 胶头滴管
请回答下列问题:
⑴ 配制稀硫酸时,还缺少的仪器有 (填写仪器名称)。
⑵ 经计算,配制500mL0.2mol/L的稀硫酸需要上述浓硫酸的体积为 ,量取浓硫酸时应选用 (选填 ① 10mL、② 50mL 、③ 100mL)规格的量筒。
⑶稀释浓硫酸时,应如何操作? 。
⑷ 某同学定容时,加水超过容量瓶的刻度线,再用胶头滴管吸去,则所配制的稀硫酸物质的量浓度 (填写“偏大”、“偏小”或“ 不变”)。
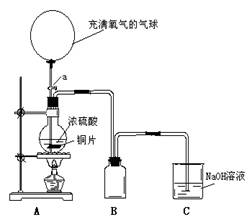 16.(14分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置并进行有关实验。
16.(14分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置并进行有关实验。
请回答下列问题:
⑴ 先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有少量铜片剩余。
①写出上述过程中烧瓶内发生的化学方程式:
。
②B是用来收集实验中产生的气体的装置,但导 管未画全,请直接在原图上把导管补充完整。
③装置C的作用是 。
⑵ 事实表明,上述反应全部结束后,硫酸仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。写出发生反应的总的离子方程式 。
⑶反应全部结束后,为充分利用药品,该小组同学取烧瓶中的少量溶液于烧杯中,加水稀释后,再加入金属钠继续进行实验。意外地发现生成的蓝色沉淀中混有少量黑色沉淀。你认为该黑色难溶物是 ,生成该黑色难溶物的可能原因是
。
四、(本题包括2小题,共29分)
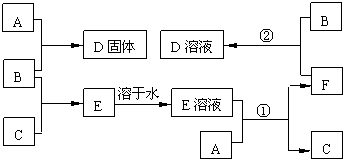 |
17.(11分)下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属单质,B、C为常见非金属单质。 E的水溶液呈无色,能使紫色的石蕊试液变红色,加入AgNO3溶液生成不溶于稀硝酸的白色沉淀。在适当的条件下,它们可以按下面框图进行反应。
试回答下列问题:
⑴B的电子式是____________,C的分子式是__________;E属于__________(选填“离子”或“共价”)化合物。
⑵反应②的离子方程式是_____________________________。
⑶鉴别D和F两种物质水溶液的方法是 。
18.(18分)下图是元素周期表中的前四周期。现有①~⑥六种元素,在元素周期表中的位置如图所示,试回答下列问题:
| ① | |||||||||||||||||
| ③ | ④ | ||||||||||||||||
| ② | ⑤ | ||||||||||||||||
| ⑥ | |||||||||||||||||
⑴上述六种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
⑵元素①和③可以形成众多的化合物,其中最简单的是 (写化学式),
该化合物中,化学键的类型为 。
⑶元素④的最高氧化物的水化物,其稀溶液能与Cu发生反应,反应中该稀溶液的作用是 。
⑷元素⑤的最外层电子数为 ;元素⑤和⑥相比,非金属性强的是 ,能说明该结论的化学事实为 (用离子方程式表示)。
五、(本题包括2小题,共19分)
19.(9分)将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后,测得容器内CO2的体积为1.12L(标准状况)。将反应后的固体残渣Y与过量的稀盐酸反应,生成3.36L(标准状况)的CO2。试回答:
⑴Y的主要成分是 (写化学式)。
⑵原混合物中NaOH的质量为 ;NaHCO3的质量为 。
20.(10分)含氮(设氮元素都以NO3-的形式存在)废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—
⑴现要除去含NO3-的物质的量浓度为3×10-4mol/L的废水,每吨废水至少需要消耗金属铝__________g(假设废水的密度为1g/cm3)。
⑵事实上,金属镁比铝能更快消除水体中氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_____________________________ 。
②目前国际现货市场每吨镁粉为1730美元左右,每吨铝粉的价格为3585美元左右,从价效比的角度出发,请通过计算分析应选用哪种金属清除水体中的氮元素经济上更合算?
高一化学调研试题参考答案
及评分标准
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1. D 2. C 3. B 4. A 5. C 6. D 7. C 8. A
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9.D 10. BC 11. AD 12. C 13.BD 14. C
三、(本题包括2小题,共24分)
15.⑴500 mL的容量瓶 ⑵5.4 mL 10 mL ⑶在烧杯中加适量的水,将浓硫酸缓缓加入水中,不断用玻璃棒搅拌 ⑷偏小 (每空2分,共10分)
16.⑴①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O ②B装置中导气管长进短出(图略) ③吸收SO2,防止空气污染 ⑵2Cu+4H++O2=2Cu2++2H2O ⑶ CuO Na与剩余硫酸铜溶液反应放出大量的热,使生成的Cu(OH)2部分分解
CuSO4 + SO2↑+ 2H2O ②B装置中导气管长进短出(图略) ③吸收SO2,防止空气污染 ⑵2Cu+4H++O2=2Cu2++2H2O ⑶ CuO Na与剩余硫酸铜溶液反应放出大量的热,使生成的Cu(OH)2部分分解
(除方程式3分外,其余每空2分,共14分)
四、(本题包括2小题,共29分)
17.⑴![]() H2 共价 ⑵ 2Fe2++Cl2 =2Fe3+ +2Cl― ⑶滴入少量KSCN溶液,溶液出现血红色的是D溶液,溶液无明显变化的是F溶液 (其它合理答案均给分)
H2 共价 ⑵ 2Fe2++Cl2 =2Fe3+ +2Cl― ⑶滴入少量KSCN溶液,溶液出现血红色的是D溶液,溶液无明显变化的是F溶液 (其它合理答案均给分)
(除方程式3分外,其余每空2分,共11分)
18.⑴ 第三周期、第IA族 2Na+O2![]() Na2O2 ⑵ CH4 (极性)共价键
⑶ 作氧化剂和酸 ⑷7 ⑤ Cl2+2Br-=2Cl-+Br2
(其它合理答案均给分)
Na2O2 ⑵ CH4 (极性)共价键
⑶ 作氧化剂和酸 ⑷7 ⑤ Cl2+2Br-=2Cl-+Br2
(其它合理答案均给分)
(除方程式3分外,其余每空2分,共18分)
五、(本题包括2小题,共19分)
19.⑴ Na2CO3 ⑵ 4 g 16.8 g (每空3分,共9分)
20.⑴13.5 (3分)
⑵ ①2NO3-+5Mg+6H2O==N2↑+5Mg(OH)2+2OH- (3分)
②除去等量的NO3-消耗镁粉、铝粉的物质的量之比:n(Mg):n(Al)=3:2
消耗镁粉、铝粉的质量之比:m(Mg):m(Al)=3×24:2×27=4:3
消耗镁粉、铝粉的价格之比:4×1730:3×3585<1
故选用金属镁清除水体中的氮元素经济上更合算。(其它合理方法均给分) (4分)