高二化学下学期月考试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg—24 Al—27 S-32 Cl-35.5 Fe-56 Cu-64
一、单项选择题
1.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是
A.研制水溶剂涂料替代有机溶剂涂料
|
|
![]()
![]()
|
![]() D.用反应:2CH2=CH2+O2 2CH2—CH2制备环氧乙烷
D.用反应:2CH2=CH2+O2 2CH2—CH2制备环氧乙烷
2.下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:硫酸、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨
A.①③④ B.②④ C.②③④ D.③⑤
3.下列有关化学用语正确的是
A.乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体
B.北京奥运会奖牌——“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
![]() C.次氯酸的结构式为:H—Cl—O
C.次氯酸的结构式为:H—Cl—O
D.丙烷分子的比例模型示意图:
4. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
A.铝是一种较活泼的金属,
B.铝与氧气反应放出大量的热量
C.铝片上生成的白毛是氧化铝和氧化汞的混合物
D.实验中发生的反应都是氧化还原反应
5.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
6.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:
![]() 2KClO3 + H2C2O4 + H2SO4 2ClO2↑+ K2SO4 + 2CO2↑+ 2H2O
2KClO3 + H2C2O4 + H2SO4 2ClO2↑+ K2SO4 + 2CO2↑+ 2H2O
下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2 是氧化产物
C.H2C2O4在反应中被还原 D.1 mol KClO3 参加反应有 2 mol 电子转移
7.已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘。在下列物质中,应加入的物质是
A.H2O B.Zn C.KI D.NaCl
8.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是
①用pH试纸测定Na 2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
A.②③⑦ B.③④⑤ C.⑤⑥⑦ D.④⑥⑦
二、不定项选择题
9.下列离子方程式书写正确的是
A.过氧化钠固体与水反应: 2O22—+2H2O == 4OH-+O2↑
B.NaHS溶液呈碱性:HS—+ H3O+ ![]() H2S + H2O
H2S + H2O
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3++7SO42—+7Ba2++14OH—==2Al(OH)3↓+2AlO2—+7BaSO4↓+4H2O
D.稀HNO3中加入过量铁粉: Fe + NO3— + 4H+ == Fe3+ + NO↑+ 2H2O
10.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-![]() H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol·L―1的H2A溶液
② 0.01mol·L―1的NaHA溶液
③ 0.02mol·L―1的HCl溶液与0.04mol·L―1的NaHA溶液等体积混合
④ 0.02mol·L―1的NaOH溶液与0.02mol·L―1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是
![]() A.溶液②中存在水解平衡:HA—+H2O
H2A+OH—
A.溶液②中存在水解平衡:HA—+H2O
H2A+OH—
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)浓度大小:③>①>②>④
11.
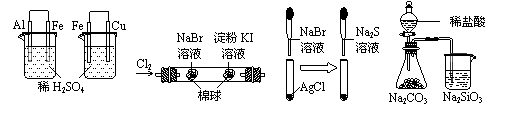 |
根据下列实验现象,所得结论正确的是
A B C D
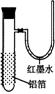
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl>AgBr>Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
12.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由LiAlCl4溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li +3SOCl2==6LiCl +Li2SO3 +2S,下列有关叙述正确的是
A.金属锂作电池的正极,石墨作电池的负极
B.电池工作过程中,SOCl2被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4 :1
13.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,不正确的是
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
14.在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)![]() xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A.平衡时,甲、乙两容器中A、B的物质的量之比不相等
B.若平衡时,甲、乙两容器中A的物质的量相等,则x=2
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为5∶8
三、(本题包括1小题)
15. DIS数字化信息系统因为可以准确测量溶液的pH而在中和滴定的研究中应用越来越广泛深入。某学习小组利用DIS系统探究强碱和不同酸的中和反应的过程如下:
实验步骤:
①.分别配制0.1mol/L的NaOH、HCl、CH3COOH、H3PO4溶液备用。
②.在锥形瓶中加入10mL0.1mol/L的HCl,在25.00mL碱式滴定管中加入0.1mol/L的NaOH,连接数据采集器和pH传感器。
③.向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④.存储计算机绘制的pH变化图。
用0.1mol/L的CH3COOH、H3PO4溶液代替HCl重复上述②~④。
⑤.结果分析。
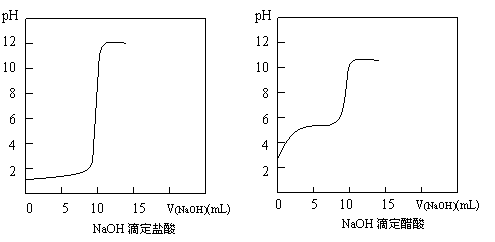 ⑴.NaOH滴定HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有:
⑴.NaOH滴定HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有:
①. ;
②. ;
③. ;
⑵.你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”),理由是 ;如果不可行,你建议的简易改进方法是 (如认为可行,此空不答)。
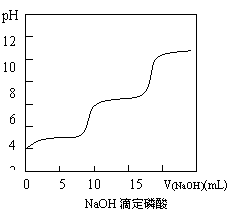 ⑶.右图是改进后的NaOH滴定磷酸的pH变化曲线图,已知曲线右端NaOH已过量。
⑶.右图是改进后的NaOH滴定磷酸的pH变化曲线图,已知曲线右端NaOH已过量。
①.该图与上述两图的不同点是:
;
②.写出磷酸的电离方程式:
;
③.你认为曲线中没有第三个突跃的可能原因是
。
四、(本题包括1小题)
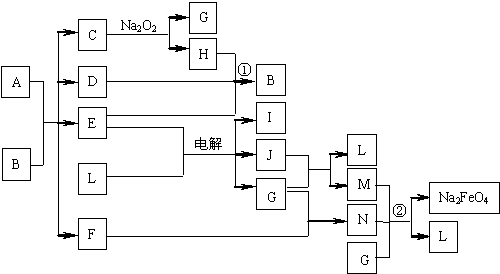 |
16. A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物。甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其化学式量分别为124、180。图中C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体;部分生成物没有列出。
请填写以下空白:
(1)C的电子式为 ,甲和乙的化学式分别为 、 ;
(2)反应①的化学方程式 ;
电解E、L混合物的离子方程式 ;
(3)钢铁的表面发蓝、发黑处理是常用的防腐方法。6Na2FeO2+ NaNO2+ 5H2O = 6NaFeO2+ NH3↑+ 7NaOH是主要处理反应之一。而工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
五、(本题包括1小题)
![]() 17.目前用于抗幽门螺旋杆菌的常见高效抗生素是氨苄青霉素,它可由青霉素来合成。
17.目前用于抗幽门螺旋杆菌的常见高效抗生素是氨苄青霉素,它可由青霉素来合成。
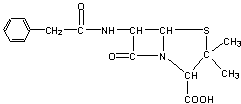
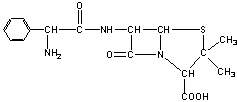
青霉素(C16H18N2O4S) 氨苄青霉素(C16H19N3O4S)
![]()
已知:…-C-NH-…+H2O
![]() …-C-OH+H2N-…
…-C-OH+H2N-…
下图是青霉素制取氨苄青霉素的合成路线:
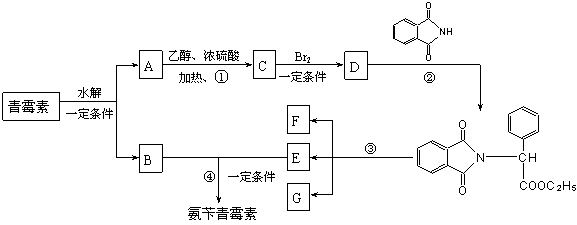
请回答下列问题:
⑴写出反应①②③④的反应类型
① , ② , ③ , ④ ;
⑵写出D的结构简式 ;
⑶写出反应①③的化学方程式:
① ,
③ 。
六、(本题包括1小题)
18. “嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是
; 。(请写两条)
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学化方程式:
H2(g)+1/2O2(g) H2O(l);△H=-285.8kJ/mol
C(g)+O2(g)CO2
(g);△H=-393.5kJ/mol
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l);△H=-890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
(3)已知:H2(g)=H2(l);△H=-0.92kJ/mol O2(g) O2(l);△H=-6.84kJ/mol
H2O(l)=H2O(g);△H=+44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。
如果此次嫦娥一号所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,
总共释放能量 kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;
总反应式: 。
(5)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。(写出计算过程)
①若溶液体积仍为100mL,此时溶液的pH为多少?(不考虑硫酸铜水解)
②此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
七、(本题包括1小题)
19. 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的二价阴离子为 (填电子式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a. 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
化学参考答案
1.C 2.D 3.B 4.C 5.B 6.A 7.C 8.B
9.C 10.C D 11AC 12.D 13.B D 14.B
三、(本题包括1小题,)
答案⑴① 起点pH不同,盐酸的小,醋酸的大;② 均有一个pH突跃;③ 盐酸中开始pH上升慢,突跃前突然变快,醋酸中开始pH上升快,突跃前因为缓冲溶液的作用而使pH上升变慢。
⑵不可行;NaOH的用量超过了所用碱式滴定管的最大体积读数;减少磷酸的体积;
⑶① 有两个pH突跃;
![]()
![]()
![]() ② H3PO4 H+
+ H2PO- 4;H2PO- 4 H+
+ HPO2- 4;HPO2- 4 H+
+ PO3- 4;
② H3PO4 H+
+ H2PO- 4;H2PO- 4 H+
+ HPO2- 4;HPO2- 4 H+
+ PO3- 4;
③Na2HPO4的碱性已经较强,pH较大,与NaOH反应生成Na3PO4后,pH变化不大,所以没有pH突跃现象。
四、(本题包括1小题)
16.(1)![]() Fe2C Fe3C
Fe2C Fe3C
(2)4NO2+O2+2H2O=4HNO3
2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑
(3)硝酸易挥发,且不稳定,见光易分解,故不易操作;生成物对环境污染严重
五、(本题包括1小题)
![]() 17. ⑴①酯化(取代) ②取代 ③水解(取代) ④取代
17. ⑴①酯化(取代) ②取代 ③水解(取代) ④取代
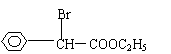 |
⑵
⑶①
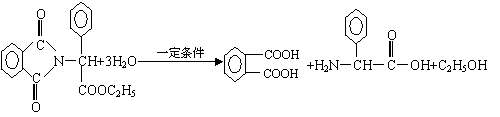 ③
③
六、(本题包括1小题)
18.(1)相同质量时,氢气放出的热量多;产物为水,无污染
(2)H2,4.4:1
(3)H2(l)+1/2O2(l) H2O(g);△H=-237.46kJ/mol; 5.94×108
(4)负极:2H2+4OH—-4e— 4H2O;正极:O2+2H2O+4e— 4OH—
总反应式:2H2+O2 2H2O
(5)(①;②)
①阴极反应为:Cu2++2e—=Cu 2H++2e—=H2↑
当阴极收集到氢气0.112L时,铜已反应完全,共转移电子0.03mol,
此时阳极2Cl—-2e—=Cl2↑反应恰好完全。
溶液中剩余的c(OH—)=0.1mol/L,溶液PH=13。
②设消耗H2和O2的质量分别为x、y。
2H2 + O2 2H2O ~ 4e—
4g 32g 4mol
x y 0.03mol
解得:x=0.03g y=0.24g
所以,消耗H2 0.03g;消耗O2 0.24g。
七、(本题包括1小题)
![]() 19.(1)①C≡O
2- (1分)
② b. c.
19.(1)①C≡O
2- (1分)
② b. c.
(2)1s22s22p63s23p63d104s24p1
Ga失去1个电子后内层电子达到全充满的稳定状态
(3)d