高二年级化学第一学期期中质量检查试卷
命题、校对:李 华 审核:曹丽敏 2006.12
特别说明: 1. 以下题目的答案请全部填写在答卷纸上。
2. 本卷总分150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
可能用到的原子量:H:1 C:12
O:16 Ba:137
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.咖喱是一种烹任辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄
色污渍变为红色。经水漂洗后红色又变为黄色。据此现象,你认为咖喱汁与下列何种试
剂可能有相似的化学作用
A.品红溶液 B.石蕊溶液 C.氯水 D.KI一淀粉溶液
2.反应3X(g)+Y(g) ![]() Z(g)+2W(g)在2L的密闭容器中进行,
5min后Y减少了0.1mol,
则此反应的平均反应速率v为
Z(g)+2W(g)在2L的密闭容器中进行,
5min后Y减少了0.1mol,
则此反应的平均反应速率v为
A.v(X)=0.03mol/(L![]() min)
B.v(Y)=0.02mol/(L
min)
B.v(Y)=0.02mol/(L![]() min)
min)
C.v(Z)=0.10mol/(L![]() min)
D.v(W)=0.20mol/(L
min)
D.v(W)=0.20mol/(L![]() min)
min)
3.在一定条件下,可逆反应:N2(g)+3H2(g) ![]() 2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是
2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是
A.加催化剂V正、V逆都发生变化且变化的倍数相等
B.加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
C.降温,V正、V逆都减小,且V正减小倍数小于V逆减小倍数
D.加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
4.有酚酞的 0.lmol/L氨水中加入少量的 NH4Cl晶体,则溶液颜色
A.变蓝色 B. 变深 C.变浅 D.不变
5.已知25℃和101kPa下, 1gC6H14(己烷)燃烧生成二氧化碳和液态水时放出48.41kJ的热量. 表示上述反应的热化学方程式正确的是
A.C6H14(l)+![]() O2(g)=6CO2(g)+7H2O(l)
O2(g)=6CO2(g)+7H2O(l) ![]() H=-48.41kJ/mol
H=-48.41kJ/mol
B.C6H14(l)+![]() O2(g)=6CO2(g)+7H2O(g)
O2(g)=6CO2(g)+7H2O(g) ![]() H=+4163kJ/mol
H=+4163kJ/mol
C.C6H14(l)+![]() O2(g)=6CO2(g)+7H2O(g)
O2(g)=6CO2(g)+7H2O(g) ![]() H=+48.41kJ/mol
H=+48.41kJ/mol
D.C6H14(l)+![]() O2(g)=6CO2(g)+7H2O(l)
O2(g)=6CO2(g)+7H2O(l) ![]() H=-4163kJ/mol
H=-4163kJ/mol
6.下列说法正确的是
A.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
B.氯化钠溶液在电流作用下完全电离成钠离子和氯离子
C.硫酸钡难溶于水,但硫酸钡属强电解质
D.强电解质溶液的导电性一定比弱电解质溶液的导电性强
7.下列方法能使电离平衡H2O![]() H+ + OH-向右移动,且使溶液呈酸性的是
H+ + OH-向右移动,且使溶液呈酸性的是
A.向水中加入少量硫酸氢钠固体
B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体
D.将水加热到100℃,使水的pH=6
8.下列几种情况下,前一个量的数值是后一个量的数值的三倍的是
A.K3PO4溶液中c(K+)与c(PO43-)
B.合成氨反应达到平衡时,H2和N2的转化率相等,则起始时H2和N2的物质的量
C.pH=3与pH=1溶液中c(H+)
D.银与浓硝酸反应时,参加反应的银的物质的量与被还原的硝酸的物质的量
二.选择题(本题包括10小题,第9—16小题每小题4分,17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.一定温度下, 向aL的密闭容器中加入2molNO2(气), 发生如下反应:
2NO2![]() 2NO+O2,
此反应达到平衡的标志是
2NO+O2,
此反应达到平衡的标志是
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO和O2的物质的量之比为2:2:1
D.单位时间内生成2nmolNO同时生成2nmolNO2
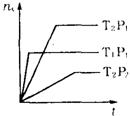 10.反应mA(气)+B(气)
10.反应mA(气)+B(气)![]() nC(气)
nC(气)![]() H=X,在不同温度(T1和T2)及压强(P1和P2)下,产物C的物质的量(nc)与反应时间(t)的关系如右图所示,下述判断正确的是
H=X,在不同温度(T1和T2)及压强(P1和P2)下,产物C的物质的量(nc)与反应时间(t)的关系如右图所示,下述判断正确的是
A.T1>T2,P1>P2,m≥n,X>0
B.T1>T2,P1>P2,m≥n,X<0
C.T1<T2,P1<P2,m≤n,X<0
D.T1>T2,P1<P2,m≤n,X>0
11.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
12.下列说法正确的是
A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B.在101kPa时,1molH2完全燃烧生成气态水,放出285.8kJ热量,H2燃烧热为285.8kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+ (aq) + OH—(aq) === H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
13.若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
14.下列反应的离子方程式正确的是
A.醋酸铵溶液和盐酸反应 CH3COONH4+H+ CH3COOH+NH![]()
B.硫化钠水解 S2-+2H2O ![]() H2S+2OH-
H2S+2OH-
C.澄清石灰水与盐酸反应 H+ + OH- = H2O
D.向稀氨水中加入稀盐酸 NH3·H2O+H+ NH![]() +H2O
+H2O
15.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中不会引起实验误差的是
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸后立即进行滴定
B.用蒸馏水洗净锥形瓶后,再用待测的NaOH溶液润洗而后装入一定体积的NaOH溶
液进行滴定
C.用碱式滴定管取10.00ml NaOH溶液放入用蒸馏水洗净的锥形瓶中再加入适量蒸馏
水进行滴定
D.滴定过程中,有两滴盐酸滴在锥形瓶内壁上,并用少量蒸馏水把盐酸冲入锥形瓶内溶
液中
16.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(OH—)>c(Na+)> c(H+)>c(CH3COO—)
B.pH>7,且c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
C.pH<7,且c(CH3COO—)>c(H+)>c(Na+)>c(OH—)
D.pH=7,且c(CH3COO—)>c(Na+)>c(H+)=c(OH—)
17.在体积均为1L,pH均等于2的盐酸和醋酸中,分别投入0.28g Fe,则下图中的曲线符合反应事实的是
 |
A B
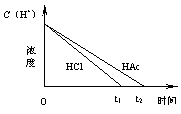
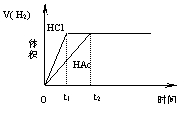
C D
18.将2 mol A和1 mol B充入某密闭容器中发生反应:2A (g)十B (g) ![]() xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a
B.若在恒温恒容下,当x=2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为a
C.若在恒温恒压下,当x=3时,1 mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x为2或3
第二卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19.(10分)(1)在纯碱溶液中滴入酚酞,可以看到____________。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(以离子方程式和简要文字说明):_______________________________________________________________________
。
(2)有些烟幕弹产生烟幕的原理是应用了水解反应。水解反应是一类广泛存在的反应,如PCl5、SiCl4易水解,PCl3的水解反应为PCl5+4H2O=H3PO4+5HCl。现代海战中,常常通过喷放SiCl4和液氨产生大量烟幕,所涉及反应的化学方程式是
。
20.(12分)(1)下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐
B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
(2)下列仪器中没有“0”刻度线的是__________
A. 温度计 B. 量筒 C. 酸式滴定管 D. 托盘天平游码的刻度尺
(3)现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②在滴定时左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
③下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = _______________________________________。
④下列操作会使NaOH浓度的测定值偏低的是___________
a酸式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准盐酸溶液
b用碱式滴定管取用待测液前,尖嘴部分有气泡,取用过程中气泡消失
c滴定前,读酸溶液体积时视线低于酸式滴定管中的液面,滴定后读酸溶液体积时,视线高于酸式滴定管的液面
d 锥形瓶用待测碱液润洗两次。
四、(本题包括2小题,共18分)
21.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)______________________________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______0.11mol/L(填“>”、“=”、“<”)。理由是______________________________________
________________________________________________________________。
(3)NaHA溶液中各离子浓度由大到小的顺序是______________________。
22.(8分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨弱电离的方程式(生成的两种粒子电子数相等): 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]— ![]() H∶OH
H∶OH
试指出下列两个反应中的酸或碱
①H3BO3 + H2O ![]() H+ + B(OH)4- 该反应中的碱是
(填:H3BO3
或 H2O)
H+ + B(OH)4- 该反应中的碱是
(填:H3BO3
或 H2O)
②NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
五、(本题包括2小题,共18分)
23.(10分) 化学工业在江苏国民经济中占有极其重要的地位,我省是国内最早的硫酸生产基地之一。
⑴硫酸生产中,根据化学平衡原理来确定的条件或措施有____________(填序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
⑵若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1molSO2和0.5molO2,此时体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.91。若保持温度和压强不变,充入1molSO3,则平衡时SO2体积分数为______;若保持温度和体积不变,充入a mol SO2和b molO2,且a∶b =2∶1,反应达平衡时SO3体积分数仍为0.91,则a =_______。
⑶硫酸工业的尾气中含有少量的SO2,常用氨水吸收后再加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为:
__________________________。
24.(8分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(Cl-)>c(H+)>c(NH4+)>c(OH-) ④c(NH4+)>c(Cl-)>c(OH-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中
c(NH4+)与c(Cl-)的关系:c(NH4+) c(Cl-)。
六、(本题包括2小题,共18分)
25.(10分)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
26.(8分)将4 mol SO3气和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g) ![]() 2SO2+O2
2SO2+O2
2NO+O2 ![]() 2NO2
2NO2
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气的物质的量为 。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
(3)若在另外一个2L的容器中只发生反应2NO+O2 ![]() 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是 (填字母代号)
。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是 (填字母代号)
。
A.c(NO)=0.35 mol/L或c(NO)=0.09 mol/L
B.c(NO2)=0.4 mol/L
C.c(NO2)=0.35 mol/L
D.c(O2)=0.2 mol/L或c(NO)=0.4 mol/L
高二年级化学答卷
一、选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | A | D | C | D | C | B | B |
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | B | D | CD | B | CD | CD | AD | B | BD |
三、
19、(1)出现红色 (1分) 红色消失,产生白色沉淀
(2分) CO32-
+ H2O ![]() HCO3-
+ OH- CO32- + Ba2+ = BaCO3↓ CO32-不断减少,使水解平衡不断向左移动,最终溶液中剩余Na+
Cl-,溶液呈中性。(3分,方程式各1分,说理1分)
HCO3-
+ OH- CO32- + Ba2+ = BaCO3↓ CO32-不断减少,使水解平衡不断向左移动,最终溶液中剩余Na+
Cl-,溶液呈中性。(3分,方程式各1分,说理1分)
(2)SiCl4 + 3H2O = H2SiO3 ↓+ 4HCl HCl + NH3 = NH4Cl (各2分,共4分)
20、(1)AC(2分) (2)B (2分) (3)用标准盐酸润洗 锥形瓶中颜色变化 半分钟内不褪色(各1分) a(V1 -V2)/Vmol (2分) bc (3分)
21、(1)碱性 (1分) A2- + H2O![]() HA- + OH-
(2分)
HA- + OH-
(2分)
(2)<(1分) 0.1mo/L的H2A先完全电离产生0.1mol H+和HA-均为0.1mol/L,(2分)当0.1mol/L的HA-电离时,第一步电离产生的H+抑制了HA-的电离,使电离出的H+的难度小于0.01mol/L,所以H+的浓度小于0.11mol/L(2分)
(3)C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-)
22、(1)2 NH3 ![]() NH4+
+NH2- (2分) (2)AD(2分) (3)H2O
H2O (各2分)
NH4+
+NH2- (2分) (2)AD(2分) (3)H2O
H2O (各2分)
23、(1)CD (2分) (2) 6% 1.455 (各3分) (3)C(NH4+)>C(SO42-)>C(H+)>C(OH-)
(2分)
24、(1)氯化铵 ① (各1分) (2)HCl和NH4Cl (2分) (3)< = (各2分)
25、(1) 0.01mol (4分) (2)8 (4分) (4)90%(2分)
26、(1)0.2mol (3分) (2)SO2 NO2 (各1分) (3) AC (3分)