高二年级化学第一学期期未考试试卷
(选修)
说明:1、考试时间为100分钟,卷面分值为120分。
2、请将选择题答案填入后面表格中,否则答题无效。
可能用到的相对原子质量:H-1 O-16 C-12 N-14 Cu-64 Ag-108
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 | 合分人 |
| 得分 |
第Ⅰ卷(选择题 共48分)
一.选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.最早提出科学的原子概念的是
A.阿伏加德罗 B.门捷列夫 C.卢瑟福 D.道尔顿
2.下列过程中,把化学能转化为热能的是
A.风力发电 B.干电池产生电流
C.木炭燃烧 D.用电取暖器取暖
3.对原子核外电子及其运动特征的描述正确的是
① 可以测定某一时刻电子所处的位置 ②电子质量很小且带负电荷 ③运动的空间范围很小 ④高速运动 ⑤有固定的运动轨道
A.①②③ B.①②⑤ C.②③④ D.②③④⑤
4.下列各种方法中,①金属表面涂抹油漆②改变金属内部结构③保持金属表面清洁干净④金属表面进行电镀⑤使金属表面形成致密的氧化物薄膜。能对金属起到防护或减缓腐蚀作用的是
A.①②③④ B.②③④⑤ C.①②④⑤ D.全部
5.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl C.Cl2 D.F2
6.在气体反应中,改变某一条件能使单位体积内反应物的活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②⑤ C.②⑤ D.除④外都可以
7.某反应:A == B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程中△H、△S的判断正确的是
A.△H>0、△S>0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H<0、△S<0
8.下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
二.选择题(本题包括8小题,每小题3分共24分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.下列事实不能用勒夏特列原理来解释的是
A.合成氨的反应中使用过量的N2
B.使用催化剂有利于合成氨的反应
C.高压有利于合成NH3的反应
D.500℃左右比室温更有利于合成NH3的生产
10.已知有下列热化学方程式:
Zn(s)+1/2O2(g)= ZnO(s); △H=-351.1KJ/mol ,
Hg(l)+ 1/2O2(g)= HgO(s) ; △H=-90.7KJ/mol,由此可知:
Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),在相同条件下的△H为
A.-441.8KJ/mol B.+260.4KJ/mol C.+441.8KJ/mol D.-260.4KJ/mol
11.在相同温度下,用同体积同浓度的盐酸与足量的石灰石反应,并在一定的时间内
测量反应所放出的CO2的体积.实验I用的是块状的石灰石,实验Ⅱ用的是粉末状的
石灰石。下列图中能正确反应两种实验结果的是
A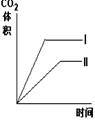 B
B C
C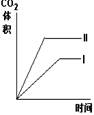 D
D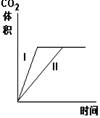
12.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.12克金刚石中含有C-C键的数目为2NA。
B.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2
C.合成氨反应达平衡时,有2molNH3 分子生成同时就有3NA个H-H形成。
D.1molP4含有4NA个P-P键。
13.下列说法不正确的是
A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。
B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。
14.下列叙述中正确的是
A.P4和NO2都是共价化合物
B.CH4和NH4+为等电子体,它们的空间结构相同。
C.C60气化和I2升华克服的作用力相同
D.共价键的本质是电子云的重叠,而电子云都有一定的伸展方向,因此共价键都具有方向性。
15.已知短周期元素的离子aA2+、bB+、cC3-、dD- 含有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.元素的第一电离能:A>B>D>C
16.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点和沸点逐渐升高
B.HF、HCl、HBr、HI的稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
 第Ⅰ卷(选择题 共48分)
第Ⅰ卷(选择题 共48分)
请将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |

第Ⅱ卷(非选择题 共72分)
三.(本题包括2小题,共18分)
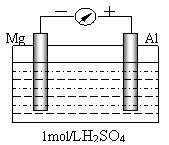 17.某研究性学习小组为了探究电解质溶液对电源电极的影响,设计了如下实验。以镁、铝为电极,稀H2SO4溶液为电解质溶液构成
17.某研究性学习小组为了探究电解质溶液对电源电极的影响,设计了如下实验。以镁、铝为电极,稀H2SO4溶液为电解质溶液构成
如图所示的原电池。实验时,铝片表面产生气泡
较多,镁条表面几乎没有气泡。
根据以上实验现象,回答下列问题:
(1)原电池的正极是______(填“Mg”或“Al”);
正极反应式是 。
(2)若以稀NaOH溶液为电解质溶液进行实验,发现铝片表面几乎没有气泡,镁条表面产生气泡较多。则原电池的负极是______(填“Mg”或“Al”);负极反应式是 ;
原电池总反应式为 。
18.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20oC | 23.3OC | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20OC | 23.5OC | |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ.0C-1.Kg-1,各物质的密度均为1g.cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
 四.(本题包括2小题,共21分)
四.(本题包括2小题,共21分)
19.按要求完成下列问题:
(1)写出Mg2+的电子排布式和轨道表达式
; 。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3) 判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角
; ; 。
(4) 若Pt(NH3)2 Cl2分子是平面结构,请画出Pt(NH3)2 Cl2可能的结构简式
、
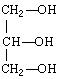 (5)用 * 标出下列属于手性分子中含有的手性碳原子
(5)用 * 标出下列属于手性分子中含有的手性碳原子
![]()
20.某离子晶体晶胞结构如下图所示,x位于立方体的
顶点,Y位于立方体中心。试分析:
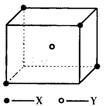 (1)晶体中每个Y同时吸引着__________个X,每
(1)晶体中每个Y同时吸引着__________个X,每
个x同时吸引着__________个Y,该晶体的化学式
为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等
的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角
∠XYX的度数为__________。

五.(本题包括2小题,共17分)
21.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排式为ns1,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
③Z元素的电离能数据见下表(kJ·mol-1):
请回答:
(1)Z 2Y中含有的化学键类型为 ,Z 2Y2的晶体类型为 。
(2)ZYX的电子式为 ,XWY的结构式为 ,X 2Y属于 (填“极性”或“非极性”)分子。
(3)晶体ZW的熔点比晶体XW的明显高的原因是
22.右图中电极a、b分别为Ag电极和Pt电极,
电极c、d都是石墨电极。通电一段时间后,b电
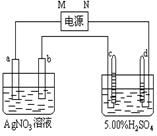 极质量增加,只有c、d两极上收集到气体。回答:
极质量增加,只有c、d两极上收集到气体。回答:
(1)直流电源中,M为 极;
电极a的反应式为 。
(2)电极b、c、d分别生成的物质的物质的量
之比为 _ __∶ ∶ 。
(3)AgNO3溶液的浓度 ( 填“增大”、“减小”或“不变”。下同 ),
H2SO4溶液的浓度 。
 |
六、(本题包括2小题,共16分)
23.已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量, 1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1) CH4的热值为 。
(2) 若将CH4和CO的混合气体1 mol完全燃烧,生成 CO2气体和液态水时,
则放出热量(Q)的取值范围是 。
(3)若将CH4和CO的混合气体a mol完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)是: 。
24.在相同温度下,向a,b两密闭容器中均同时充入0.5molA和0.2molB的混合气体,起始体积均为2L,a容器保持容积不变,b容器中的活塞可上下移动,保持压强不变。发生反应3A(气)+B(气)![]() 2C(气)+D(气)
;10min后a中达平衡,
生成物D的浓度为0.05mol.L-1, tmin后b中达平衡,生成物D的浓度为dmol.L-1。试回答下列问题:
2C(气)+D(气)
;10min后a中达平衡,
生成物D的浓度为0.05mol.L-1, tmin后b中达平衡,生成物D的浓度为dmol.L-1。试回答下列问题:
(1)a容器中前10min平均反应速率v(C)=
(2)比较大小:d 0.05(填>、<、=、或无法比较;下同);t 10;
(3)求平衡时a容器中B物质的转化率及该温度下反应的化学平衡常数K。
化学(选修)试卷参考答案及评分标准
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
二、选择题(本题包括8小题,每小题3分共24分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | C | D | B | C | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | BD | D | B | AC | A | BC | C | BC |
三、(本题包括2小题,共18分)
17.(8分,反应式每空2分,其他每空1分)
(1)Al ;2H++2e-=H2↑(2)Al; Al-3e-+4OH-=AlO2-+2H2O;
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑(用离子方程式表达也可)
18.(10分,第(3)小题每空2分,其他每空1分)
(1)量筒、温度计(2)否;金属易导热,热量散失导致误差大。
(3)①-56.8(或-56.85)KJ/mol;
②NaOH (aq) + HCl(aq) = NaCl(aq) + H2O(l) △H=-56.8KJ/mol(用离子方程式表达也可)
(4)无 ; 有
四、(本题包括2小题,共18分)
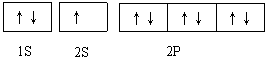 19.(11分,每空1分)(1)1S22S22P6 ;
19.(11分,每空1分)(1)1S22S22P6 ;
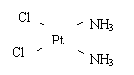
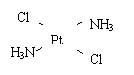
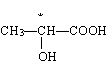 (2)Co3+ CN- 6 (3)平面正三角形; SP2 ; 1200
(2)Co3+ CN- 6 (3)平面正三角形; SP2 ; 1200
(4) (5)
20.(10分,每空2分)(1)4 ; 8; XY2或Y2X (2)12 (3)109.50 (或109028`)
五、(本题包括2小题,共15分)
![]() 21.(7分,第(3)小题2分,其他每空1分)
21.(7分,第(3)小题2分,其他每空1分)
(1)离子键;离子晶体 (2)Na+[ ∶O∶ H ]- ;H-O-Cl;极性
(3)NaCl为离子晶体,HCl为分子晶体
22.(10分,每空2分)
(1)正极 ; Ag-e-=Ag+(2)4∶1∶2(3)不变、增大。
六、(本题包括2小题,共16分)
23.(6分,每空2分)(1) 55.6KJ/g (2)283KJ<Q<890KJ (3) 586.5a KJ
24.(10分) (1) 0.01mol/(L•min) (2分) (2)> ; < (每空2分,共4分)
(3)B的转化率为50% (2分); K=10 (2分)