高二年级化学能力测试题[3]
[ ]1.下列物质的水溶液能导电,但属于非电解质的是
A.HClO B.Cl2 C.NH4HCO3 D.SO2
[ ]2.下面是合成氨的简要流程示意图:
|
|
|
 |
沿x路线回去的物质是
A.N2和H2 B.催化剂 C.N2 D.H2
[ ]3.可逆反应N2(g)+3H2(g)![]() 2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
A.3ν正(N2)= ν正(H2) B.ν正(N2)= ν正(NH3) C.2ν正(H2)=3 ν正(NH3) D.ν正(N2)=3ν 逆(H2)
![]() [ ]4.用水稀释0.1
mol·L-1 氨水时,溶液中随着水量的增加而减小的是
[ ]4.用水稀释0.1
mol·L-1 氨水时,溶液中随着水量的增加而减小的是
![]() A
B.
A
B.
C.[H+]和[OH-]的乘积 D.OH-的物质的量
[ ]5.已经建立化学平衡的某可逆反应,当改变条件使平衡向正反应方向移动时,下列有关叙述中正确的是
A.生成物的质量分数一定增加 B.生成物的物质的量一定增加
C.反应物的转化率一定增加 D.反应物的浓度一定降低
[ ]6.将固体NH4I置于密闭容器中,在某温度下发生下列反应.NH4I(s)![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g)![]() H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4
mol·L-1,则NH3的浓度为
H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4
mol·L-1,则NH3的浓度为
A.3.5 mol·L-1 B.4 mol·L-1 C.4.5 mol·L-1 D.5 mol·L-1
[ ]7.下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.碘化亚铁溶液中通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
[
]8.某温度下,在固定容积的容器中,可逆反应A (g) + 3B (g)![]() 2C (g) 达到平衡,此时测得n(A) :n(B) :n(C) = 2 :2
:1,保持温度不变,以n(A) :n(B) :n(C) = 2 :2
:1的比例向该容器再充入A、B和C,则
2C (g) 达到平衡,此时测得n(A) :n(B) :n(C) = 2 :2
:1,保持温度不变,以n(A) :n(B) :n(C) = 2 :2
:1的比例向该容器再充入A、B和C,则
A.平衡向正反应方向移动 B.平衡向逆反应方向移动 C.平衡不发生移动 D.n(A)减小
[ ]9.0.1mol·L-1的盐酸溶液中c(OH-)为
A.1mol·L-1 B.1×10-13mol·L-1 C.1×10-14mol·L-1 D.0
[ ]10. 25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离出的OH-离子浓度之比为
A.1010:1 B.5×109:1 C.108:1 D.1:1
[ ]11.恒温恒容条件下,2A(g) ![]() B(g),达到化学平衡,再向容器中通入一定量的A或者B,又重新达到平衡,新的平衡体系与旧的平衡体系比较,A的体积分数
B(g),达到化学平衡,再向容器中通入一定量的A或者B,又重新达到平衡,新的平衡体系与旧的平衡体系比较,A的体积分数
A.都减小 B.都增大 C.通入A的减小,通入B的增 D.通入B的减小,通入A的增大
[ ]12.反应A(g)+2B(g)![]() 2C(g)+2D(s) ;ΔH<0达到平衡后,如果要使v(正)增大,化学平衡向正反应方向移动,而A的转化率降低,可采取的措施是
2C(g)+2D(s) ;ΔH<0达到平衡后,如果要使v(正)增大,化学平衡向正反应方向移动,而A的转化率降低,可采取的措施是
A.升高温度 B.多加催化剂 C.缩小容器体积 D.增大A的浓度
[ ]13.对于反应2A(g)+xB(g)![]() 4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
A.1 B.2 C.3 D.4
[ ]14.下列公式哪一个能用来精确地计算任意浓度的HCl水溶液中的总c(H+)=( ) (KW为水的离子积常数)
A.c(H+)=c(HCl) B.c(H+)=c(HCl)+KW/c(H+)
C.c(H+)=c(HCl)+KW D. c(H+)=c(HCl)-KW/c(H+)
[ ]15.将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时,都将引起
A.溶液的pH增加 B.溶液中的c(H+)增大 C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
[ ]16.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
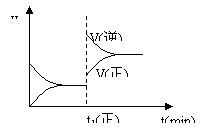 [ ]17.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
[ ]17.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g)![]() 2SO3(g) ; ΔH<0
2SO3(g) ; ΔH<0
B.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ; ΔH<0
4NO(g)+6H2O(g) ; ΔH<0
C.H2(g)+I2(g)![]() 2HI(g) ; ΔH>0
2HI(g) ; ΔH>0
D.C(s)+H2O(g)![]() CO(g)+H2(g); ΔH>0
CO(g)+H2(g); ΔH>0
[ ]18.甲、乙两容器都发生反应 2A(g)+ B(g)![]() xC(g),
xC(g),
两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,
达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4 molA,0.7 molB 和 0.6 molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2 B.若甲、乙两容器均为恒压容器,则x必等于3
C..若甲为恒容容器、乙为恒压容器,且 x= 3,则 n1必大于n2
D若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2
[
]19在容积固定的密闭容器中存在如下反应: A(g) + B(g) ![]() 3
C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
3
C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
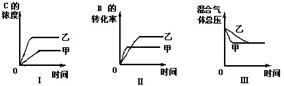 下列判断一定错误的是
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
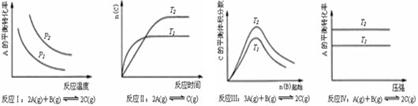 [ ]20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是
[ ]20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1<T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
![]() [ ]21.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)
[ ]21.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)![]() aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不同
D.平衡时Ⅰ容器的体积小于V L
[ ]22.对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);△H<0,有下列判断中正确的是:
cC(g)+dD(g);△H<0,有下列判断中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,(a+b)>(c+d)
D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
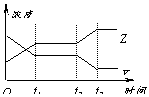 [ ]23.今有反应2X(g)+Y(g)
[ ]23.今有反应2X(g)+Y(g)![]() 2Z(g);△H<0右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
2Z(g);△H<0右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是
A.升高温度或降低Y的浓度 B.加入催化剂或增大X的浓度
C.缩小体积或降低X的浓度 D.降低温度或增大Y的浓度
24.A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A__________,D__________,E___________。
(2)B的单质在F的单质中的现象是 ,
化学方程式是
。
(3)A、C两种元素最高价氧化物的水化物的离子方程式是
。
25.下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石蕊试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
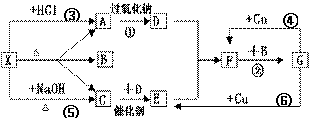 ⑴化学式:X
,C
,
⑴化学式:X
,C
,
F ,G 。
⑵反应④的化学方程式是:
;
⑶C和D反应的化学方程式:
⑷反应⑤的化学方程式
| |

| |
3A(g)+B(g)![]() 2C(g)
△H<0.
2C(g)
△H<0.
(1)若起始温度相同,分别向三个容器中充入3molA
和1molB,则达到平衡时各容器中C物质的百分含量由大
到小的顺序为__________________(填容器编号)(不考虑
活塞质量和摩擦系数) ①外有隔热套 ② ③活塞可移动
(2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3 molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
27.在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)![]() CO2(g)十H2 (g);△H<0.
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g);△H<0.
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)

t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
28. 313K时,纯水中的KW=3.8×10-14,则在该温度下,c(H+)=10-7mol/L的某溶液,呈 (选填“酸性”,“中性”,“碱性” )
29.有pH=1的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是 (用>、<、=表示,下同)。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是 ;反应过程中放出H2的速率依次为υ/1、υ/2、υ/3,则其关系是
30.已知水的电离程度随温度的升高而增大。
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=_______。
(2)向pH=6的蒸馏水和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H 2的速率前者与后者相比是 (填选项序号)。
A.一样快 B.前者快 C.后者快 D.无法比较
31.有pH=12的NaOH溶液100mL,如果将其pH降为11,那么(设两溶液混合后的体积等于混合前各体积之和)
(1)若用蒸馏水应加入______________mL。
(2)若用pH=10的NaOH溶液应加入_____________mL。
(3)若用pH=2的盐酸溶液应加入 mL。
(4)若用浓度小于0.01mol/L的醋酸应加入的体积范围是 。
32.将pH=1的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的一适量NaOH溶液后,所得溶液中H+的物质的量浓度均为0.01mol/L。则加入的水与NaOH溶液的体积比为(假定液体混合时体积有加和关系) 。
33.在四个密闭容器中,分别充入表中四种配比气体,发生下列反应:2A(g)+B(g)![]() 3C(气)+D(气),在一定条件下达到平衡后,回答下列问题:
3C(气)+D(气),在一定条件下达到平衡后,回答下列问题:
|
容器 | A/mol | B/mol | C/mol | D/mol |
| 甲 | 2 | 1 | 0 | 0 |
| 乙 | 4 | 2 | 0 | 0 |
| 丙 | 1 | 0.5 | 1.5 | 0.5 |
| 丁 | 0 | 0 | 9 | 3 |
(1)若四容器体积相同且不变,在恒温条件下达到平衡:①平衡状态完全相同的容器是(填容器编号.下同) ;②A的物质的量相同的容器是 ;③A的物质的量浓度相同的容器是 。
(2)若同温同压,四容器的体积可变,回答(1)中对应的问题:① ;② ;③ 。
参考答案
1D 2A 3C 4B 5B 6D 7D 8A 9B 10C 11A 12D 13A 14B 15A 16D 17B 18C 19A 20C 21A 22B 23D
24. (1)Na、Si、P
(2)产生白色的烟;Mg+Cl2![]() MgCl2
MgCl2
(3)OH-+Al(OH)3=AlO2-+2H2O
25. ⑴ NH4HCO3 、NH3 、NO2 、HNO3 。
⑵Cu + 4HNO3(浓)===Cu(NO3)2 + 2NO2 ↑ + 2H2O
⑶4 NH3+5 O2![]() 4NO
+6H2O;
4NO
+6H2O;
⑷NH4HCO3+NaOH ![]() NaCl+NH3↑+H2O↑
NaCl+NH3↑+H2O↑
26.(1)③②① (2)大于
27. 0.03 ①平衡 > ②d a
28.呈 碱 性
29.(1)C3>C1>C2或C3>C1=2C2 (2)V3>V1=V2
(3)n1=n3>n2或n1=n3=2n2 (4)v1=v2=v3;v´1=v´2<v´3
30.11;B
31.(1)900(2)1000(3)900/11(4)900>V>900/11
32 11:1 。
33.(1)甲丙 甲丙 甲丙
(2)甲丙 甲丙 甲乙丙丁