高二年级化学能力测试题[6]
[ ]1.已知反应A2(g) +2B2(g)![]() 2AB2(g) ;△H<0,下列说法正确的是
2AB2(g) ;△H<0,下列说法正确的是
A.升高温度,正反应速率加快,逆反应速率减慢
B.升高温度有利于反应速率加快,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该平衡向正反应方向移动
D.达到平衡后,降低温度或减小压强都有利于该平衡正反应方向移动
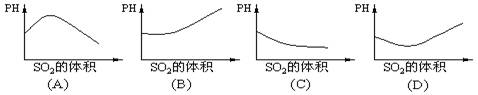
[ ]2.在室温下,向饱和H2S溶液中缓慢通入过量SO2气体,溶液的pH值随通入SO2体积的变化曲线示意图,合理的是
[ ]3. 99mL0.1mol·L-1盐酸和101mL0.05mol·L-1氢氧化钡溶液混和后,溶液的pH值为
A. 1.7 B. 10.7 C. 11 D. 11.3
[ ]4.pH值和体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是
A. 一样多 . B. 醋酸比硫酸多 . C. 硫酸比醋酸多 . D. 无法比较
[ ]5.某主族元素形成的离子X2+的最外层第五层有2个电子.当把固体XCl2溶于水配制成溶液时,需加入少量的单质X和盐酸.由此判断下列说法正确的是
A. X元素常见的化合价是+2和+5 B. X(OH)2是强碱
C. XCl2溶液显酸性 .D. X元素的最高价氧化物的水化物显强酸性
[ ]6.下列说法正确的是
A.酸式盐的溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子物质的量浓度和氢氧根离子物质的量浓度相等
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
[ ]7.把0.05molNaOH固体分别加入下列100mL液体中,溶液的导电能力几乎不变的是
A.自来水 B.0.5mol·L-1硝酸钾溶液 C.0.5mol·L-1醋酸 D.0.5mol·L-1氯化铵溶液
[ ]8.把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是:
A.0.5mol·L-1 B.0.1mol·L-1 C.0.05mol·L-1 D.1mol·L-1
[ ]9.已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH-)=1×10-3mol·L-1的碱溶液等体积混和后溶液呈酸性.其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
[ ]10.向一定体积的0.1mol·L-1的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是
A.溶液的pH值变小 B.醋酸的电离程度降低
C.溶液的导电能力减弱 D.中和此溶液所需的0.1mol·L-1NaOH溶液的体积增加
[ ]11.用pH试纸测定某无色溶液的pH值时,规范的操作是
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在试管口,观察颜色跟标准比色卡比较
[ ]12.能够使醋酸溶液的pH值和醋酸的电离程度都减小的是
A.滴加少量H2SO4溶液 B.加入少许水稀释 C.滴加少量NaOH溶液 D.加入少许CH3COONa晶体
[ ]13.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生下述反应:A(g)+3B(g)![]() 2C(g)若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ①原混和气体的体积为1.2VL; ②原混和气体的体积为1.1VL;
③反应达平衡时气体A消耗掉0.05VL; ④反应达平衡时气体B消耗掉0.05VL;
2C(g)若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ①原混和气体的体积为1.2VL; ②原混和气体的体积为1.1VL;
③反应达平衡时气体A消耗掉0.05VL; ④反应达平衡时气体B消耗掉0.05VL;
A.②③
B.②④
C.①③
D.①④
[ ]14.把三氯化铁溶液蒸干灼烧,最后得到的固体产物是。
A.无水三氯化铁 B.氢氧化铁
C.氧化亚铁 D.三氧化二铁
[ ]15.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)![]() Ca2+-(aq)+2OH- -(aq) 加入以下溶液可使Ca(OH)2减少的是
Ca2+-(aq)+2OH- -(aq) 加入以下溶液可使Ca(OH)2减少的是
A.Na2S溶液 B.AlCl3溶液 C.NaOH溶液 D.CaCl2溶液
[ ]16.将0.1mol下列物质置于1L水中充分搅拌后,溶液中的阴离子数目最多的是
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4
[ ]17.在室温下等体积的酸和碱的溶液,混和后pH值小于7的是---
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液
[ ]18.依照阿佛加德罗定律,下列叙述正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强之比
[ ]19.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2
== CaCO3¯+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+
== Fe3++4H2O
C.用氨水吸收少量二氧化硫:NH3.H2O+SO2 == NH![]() +HSO
+HSO![]()
D.硝酸铁溶液中加过量氨水: Fe3++3NH3.H2O == Fe(OH)3¯+3NH![]()
[ ]20.室温下,在pH=12的某碱溶液中,由水电离的c(OH-)为
A.1.0×10-7 mol·L-1 B.1.0×10-6 mol·L-1 C.1.0×10-2 mol·L-1 D.1.0×10-12 mol·L-1
[ ]21.水的电离过程为H2O![]() H++OH-,
在不同温度下其平衡常数为 K(25℃)=1.0×10-14,
H++OH-,
在不同温度下其平衡常数为 K(25℃)=1.0×10-14,
K(35℃)=2.1×10-14。则下列叙述正确的是
A. C(H+)随着温度升高而降低 B. 在35℃时,C(H+)>C(OH-)
C.水的电离程度(25℃)>(35℃) D.水的电离是吸热的
[ ]22.取pH值均等于2的盐酸和醋酸分各100mL分别稀释二倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多 B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率慢 D.盐酸和醋酸分分别与锌反应的速率一样快
[ ]23.1molX气体跟a rnol Y气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() bZ(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a=1,b=2 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
[ ]24.HClO是比H2CO3还弱的酸,反应:Cl2+H2O![]() HCl+HClO达平衡,要使HClO浓度增加可加入
HCl+HClO达平衡,要使HClO浓度增加可加入
A.H2S(g) B.CaCO3(s) C.H2O D.NaOH(s)
 [ ]25.在一定条件下,某密闭容器中发生了如下反应:2SO2(g)+O2 (g)
[ ]25.在一定条件下,某密闭容器中发生了如下反应:2SO2(g)+O2 (g)![]() 2SO3(g);△H<0, 反应达到平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
2SO3(g);△H<0, 反应达到平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
A. 1.8mol B. 2mol C. 2.2mol D. 2.4mol
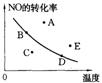
[ ]26.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)![]() 2NO2(g)△H<0. NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是
2NO2(g)△H<0. NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且正反应速率大于逆反应速率的点是
A. C点 B. A点或E点 C.B点 D.D点
[ ]27.恒温恒压下,在容积可变的密闭容器中发生反应:A(g)+B(g)![]() C(g)。若开始时通入1molA和1mol B,达到平衡后生成amol C,则下列说法错误的是
C(g)。若开始时通入1molA和1mol B,达到平衡后生成amol C,则下列说法错误的是
A.若开始通入3mol A和3mol B,达到平衡后将生成3a mol C
B.若开始通入x mol A、3mol B和1mol C,达到平衡后密闭容器中有1mol A和3mol C,则x为3
C.若开始时通入4 mol A、2 mol B和1 mol C,达到平衡时,B的物质的量一定大于2mol
D.若开始时通入2molA、2 mol B和1 mol C,达到平衡后,再通入3 molC则再次到达平衡后,C的物质的量分数为a/(2-a)
28.A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:① A与B反应有气体生成;② B与C反应有沉淀生成;③ C与D反应有沉淀生成; ④ D与E反应有沉淀生成;⑤ A与E反应有气体生成; ⑥ 在②和③的反应中生成的沉淀是同一种物质。
请填空:
⑴在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
⑵A是 ,B是 ,C是 ,D是_ BaCl_ ,E是_ NaHSO__。
⑶A与E反应的离子方程式是 。
29.已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性,0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性,请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),原因是
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸,此反应的氧化剂是 ,反
应的离子方程式为 。
30.向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的庄强为起始时的1.2倍,则用Y的物质的量浓度变化表示
的速率为 mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3. 5mol/L·min; 乙v(Y)=2mol/L·min; 丙v(Z)=4.5mol/L·min; 丁v(X)=0. 075
mol/L·s 。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不 移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较
A.无法确定 B.⑷一定大于⑴ C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)
的平衡等效,则a、b、C应该满足的关系为
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)
的平衡等效,且起始时维持化学反应向逆反应方向进行,则C的取值范围应该为
31.在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,如氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子间可以形成链状结构,氮原子间也可形成链状结构,假设氮、氢原子间只以N-N键或N-
H键形式连接,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的NH3对农业、化学和国防工业具有重要意义。其合成原理是:N2(g)+3H2(g)![]() 2NH3(g);△H=-92kJ/mol。
2NH3(g);△H=-92kJ/mol。
①在一定温度下,将1molN2和4molH2气体通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内的压强为起始时的80%。此时反应放出的热量为 。
②保持温度不变,在相同的容器中,将起始时刻物质的量设为amolN2、bmolH2和cmolNH3,欲使平衡时NH3的物质的量分数为25%,则
I.达到平衡时,①与②放出的热量 (填字母)
A.一定相等 B.前者一定小于后者 C.前者等于或小于后者 D.前者等于或大于后者
II.若该反应正向进行,则a的取值范围是 。
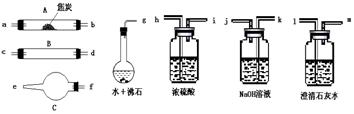 32.水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)回答下列问题:
32.水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)回答下列问题:
⑴盛浓硫酸的装置的用途是
盛NaOH溶液的装置的用途是
⑵仪器B中需加入试剂的名称(或化学式)是: ,
所发生反应的化学方程式是: 。
⑶仪器C中加试剂的名称(或化学式)是 ,
其目的是 。
⑷按气流方向连接各仪器,用字母表示接口的连接顺序:g-ab
⑸能证明混合气中含有CO的实验依据是 。
能证明混合气中含H2的实验依据是 。
33.为了证明一水合氨是弱电解质,甲、乙、丙三名学生分别选用下列试剂进行实验:0.10 mol·L-1氨水、0.1 mol·L-1 NH4Cl 溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol·L-1氨水pH为10, 则认定一水合氨是弱电解质,你认为这一方法是否
正确?_________(填“是”或“否”),并说明理由:
(2)乙取出10 mL 0.10 mol·L-1 氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足的关系用含a、b等式或不等式表示______________________________
(3)丙取出10 mL 0.10 mol·L-1 氨水,滴入 2 滴酚酞试液,显粉红色,再加入CH3COONH4晶体少量(提示:CH3COONH4溶于水时醋酸根离子和铵根离子的水解程度相当),氨水的颜色变(填“深”或“浅”) ______________;你认为这一方法 (填“能”或“否”)证明一水合氨是弱电解质.
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明一水合氨是弱电解质:
参考答案
1B 2A 3C 4B 5C 6C 7D 8C 9B 10C 11C 12A 13A 14D 15B 16C 17D 18D 19D 20D 21D 22B 23D 24B 25A 26A 27C
28.⑴__ AgCl__。
⑵A是_ Na2CO3 __,B是__ HCl__,C是_ AgNO3__,D是_ BaCl2 _,E是_ NaHSO4__。
⑶2H++CO32-===CO2+H2O↑ 。
29.(1)弱酸;若高碘酸是强酸,则pH=2的高碘酸溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液应呈中性,呈酸性说明高碘酸部分电离,为弱电解质。
(2)高碘酸(H3IO5);5H3IO5+2Mn2+![]() 2MnO4-+5 IO3-
+2H2O+11H+
2MnO4-+5 IO3-
+2H2O+11H+
30.(1)0.03
(2). 丁>乙>甲>丙
(3)不,右
(4)D
(5) C=3b,a≥0
(6)0.9<a≤4.5
31.(1)NmHm+2(m为正整数)
(2) ① 46kJ; ② I. D; II. 20.5<a≤1
32.(1)除去水蒸气 除去CO2
(2)氧化铜CuO
CuO+H2![]() Cu+H2O
CuO+CO
Cu+H2O
CuO+CO![]() Cu+CO2
Cu+CO2
(3)无水硫酸铜(CuSO4) 检验水蒸气进一步确认原混合气体中含有氢气.
(4)(g-ab)―kj―hi―cd (或dc)―fe―lm
(5)原混合气体中的CO2已被除去,其中CO与CuO 反应生成的CO2使澄清石灰水变浑浊
(6)原混合气体中的H2O已被除去,其中H2与CuO 反应生成的H2O使无水硫酸铜由白色变为蓝色
33.(1) 是 常温下,对0.1 mol·L—1 NaOH溶液pH为13,而0.1 mol·—1氨水pH为10
(2)( a-b )<2
(3) 浅 能
(4) 取适量NH4Cl晶体溶于水,pH试纸测定溶液pH值小于7