高二年级理科化学教学质量检测
化学试题卷
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量:
Cu 64 Fe 56 Al 27 O16 N 14 P 31 Cl 35.5 C 12 S 32 Ba 137 H 1
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是
A. 铜和稀硝酸反应 B.氮气和氧气发生反应
C. 氨的催化氧化 D. 二氧化氮气体溶于水
2.可以判断某酸是强电解质的依据是
A. 该酸加热至沸腾也不分解 B. 该酸可溶解氧化铜
C. 该酸可跟石灰石反应,放出CO2 D. 该酸浓度为0.001mol·L-1时其pH小于3
3.一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.混和气体中N2、H2和NH3的质量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每减少1molN2,同时增加2molNH3
4.下列关于金属元素的叙述正确的是
A.金属元素单质只有还原性,其离子只有氧化性
B.金属元素的单质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.金属元素的单质均为电的良导体
5.下列物质的命名不正确的是
A.2—甲基丙烷 B.2,3,3—三甲基丁烷
C.1—丁烯 D.异丁烷
6.利用金属M(活泼性比氢强)和石墨棒N构成原电池,电解质溶液为稀硫酸,关于此装置的下列说法中正确的是
A.M为正极,N为负极 B.导线上有电流通过,电流的方向从M→N
C.反应后,M极质量减小 D.M极上发生还原反应
7.对于下列各组反应,反应开始时,产生氢气速率最快的是
A.70℃,将0.1 mol 镁粉加入到10 mL 6 mol·L-1 的硝酸溶液中
B.60℃,将0.1 mol 镁粉加入到10 mL 3 mol·L-1 的盐酸溶液中
C.60℃,将0.1 mol 铁粉加入到10 mL 3 mol·L-1 的盐酸溶液中
D.60℃,将0.1 mol 镁粉加入到10 mL 3 mol·L-1 的硫酸溶液中
8.向某溶液中加入含Fe2+的溶液后,溶液颜色无明显变化。当再滴入几滴新制氯水后,混合液变成血红色,则下列结论中错误的是
A.原溶液中一定含有SCN- B.氧化性:Fe3+ >Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氧化为Fe3+
9.采取下列措施时不能改变正反应速率的是
A.加入催化剂 B.移除产物 C.升高温度 D.减小反应试剂的浓度
10、11题需要用到下述反应(未配平) ![]()
10.该反应中被还原的是
A.ClO3- B.Br- C.Cl2 D.Br2
11.方程式配平后,ClO3-和Br-化学计量数之比为
A.1:1 B.1:2 C.1:3 D.1:5
12.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合,最终所得的溶液
A.一定呈碱性 B.可能呈酸性 C.可能呈中性 D.一定呈中性
13.pH相同的氨水、KOH和Ba(OH)2溶液,分别用蒸馏水稀释到原体积的100倍,稀释后3种溶液的pH大小叙述正确的是
A.仍相等 B.氨水最大 C.KOH最大 D.Ba(OH)2最大
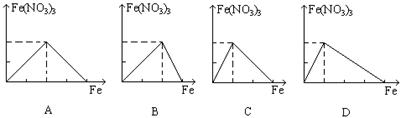
14.过量铁跟一定量硝酸反应最终生成硝酸亚铁, 下列图象是表示铁和反应过程中生成的硝酸铁之间的物质的量(mol)的关系, 其中正确的是
15.常温下,0.1mol·L-1的酸HA溶液的pH>1,0.1mol·L-1的碱BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是
A.HA是一种强酸 B.反应后BOH有剩余
C.反应后混合液呈中性 D.反应后混合液中还含有HA分子
16.在下表中,欲用一种试剂Z来检验盐溶液中的离子X。在同时有离子Y存在时,此检验仍可以明确判断的是
| 试剂Z | 离子X | 离子Y |
| A NH3·H2O B AgNO3 C Na2SO4 D Ba(NO3)2 | Al3+ Cl- Ba2+ SO42- | Mg2+ CO32- Ca 2+ Cl- |
17.某烃完全燃烧后,生成的H2O和CO2的物质的量之比为6:5。该烃的链状同分异构体的数目应是
A.3 B.2 C.4 D.5
18.某学生设计下列实验,证明氢氧化钠溶液能使酚酞变红是OH-的性质,其中实验设计不合理的是
A.取KOH、Ca(OH)2、Ba(OH)2溶液分别滴入酚酞试液,观察溶液颜色
B.取NaOH、NaCl、HCl溶液分别滴入酚酞试液,观察溶液颜色
C.向滴有酚酞的20.0mL 0.1 mol·L-1NaOH溶液中,逐滴加入25.0 mL 0.1 mol·L-1 HCl,观察溶液颜色
D.向滴有酚酞的25 mL 0.1 mol·L-1 HCl溶液中,逐滴加入20.0 mL 0.1 mol·L-1 NaOH溶液,观察溶液颜色
19.用0.1000mol·L-1的盐酸溶液滴定未知浓度的NaOH溶液时,下列操作正确的是
A.装碱液的锥形瓶用NaOH溶液润洗
B.滴定时,眼睛注视酸式滴定管中液面的下降情况
C.应用右手控制酸式滴定管的活塞
D.若用甲基橙作指示剂,到滴定终点时锥形瓶内液体为橙色
20.下列反应离子方程式书写错误的是
A.次氯酸钙溶液中通入少量的二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量二氧化硫:2NH3·H2O+SO2=2NH4++SO32-+H2O
D.硝酸铁溶液中加入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
二、简答题(本大题共5小题,共30分)
21.(6分)写出以下化学方程式或离子方程式
(1)由电石制取电石气的化学方程式 ▲ 。
(2)金属锰熔点很高,一般用铝热反应制取,写出二氧化锰与铝在引发剂作用下的反应方程式 ▲ 。
(3)向FeBr2溶液中通入足量的氯气,充分反应。写出反应的离子方程式 ▲ 。
22.(6分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
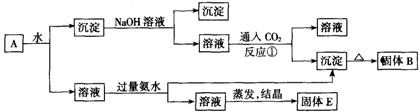
据此判断:
(1)固体B所含物质的化学式为________▲______。
(2)固体E所含物质的化学式为____ ▲__、__▲ _。
(3)反应①的离子方程式为_______▲_______。
23.(6分)现有浓度均为0.1 mol·L-1的四种电解质溶液:
①NaHCO3 ②NaAlO2 ③CH3COONa ④NaOH
(1)若上述四种溶液pH相同,其物质的量浓度由大到小的顺序是 ▲ (填编号)。
(2)将四种溶液稀释相同倍数时,其pH变化最大的是 ▲ (填编号)。
(3)在上述四种溶液中,分别加入FeCl3溶液,能产生的共同现象是 ▲ ,能产生气体的 ▲ (填编号)。
24.(6分)在有机溶剂里使3 mol PCl5 与 3molNH4Cl定量地发生完全反应,释放出12mol的HCl,同时得到一种白色固体A 1mol;A的熔点为113℃,在减压下50℃即可升华。
(1)PCl5分子中磷原子和氯原子是否均达到8电子稳定结构? ▲ (选填“是”或“否”)
(2)固体A的相对分子质量为 ▲ 。
(3)分子结构测定实验表明,A分子结构中N、P原子组成六元环,且满足P五价,N三价,Cl一价(此处的“价”指成键时共用电子对数目)。画出A的结构式 ▲ 。
25(6分)、反应aA(g)
+bB(g) ![]() cC(g) +d D(g) 在容积不变的密闭容器中达到化学平衡,且起始时A与B的物质的量之比为a :b,则:
cC(g) +d D(g) 在容积不变的密闭容器中达到化学平衡,且起始时A与B的物质的量之比为a :b,则:
(1)达到平衡后,A、B的转化率之比是 ▲ 。
(2)达到平衡后,若升高温度,C的质量分数降低,则该反应的正反应 ▲ 反应(填“吸热”或“放热”)
(3)若同等倍数地增大A、B的物质的量浓度,并在原温度下达到平衡时,A与B的转化率也同时增大,则(a+b)与(c+d)的关系是(a+b) ▲ (c+d)。(填“>”、“<”、“=”或“无法确定”)
三、实验题(本大题共3小题,共20分)
26.(6分)以前人们发现把绿色的柠檬放在用煤油炉加温的帐篷里,可使其快速成熟,于是认为适当的温度是催熟柠檬的条件,但当把煤油炉换成暖气设备时,却没有得到预期的催熟效果,后来人们研究后断定催熟的因素是煤油未完全燃烧的气体中的一种成分。
(1)你认为上述有催熟性能的物质最有可能是下列中的 ▲ (选填编号)。
①甲烷 ②乙烯 ③乙炔 ④CO
(2)若要证实你的猜想,可将煤油未完全燃烧的气体收集起来后,通入 ▲ 溶液,若观察到 ▲ 现象,你的猜想可得到初步证实。
27.(6分)某有机物在氧气中充分燃烧后,产物只有二氧化碳和水蒸气。甲、乙两组同学分别用A、B两种方法测定它的组成,如下图,得到两组数据,请你分析。正确方法应是_____▲_____,简述错误方法的缺陷 ▲ 。该有机物的分子式可能为 ▲ (实验过程中气体均全部被吸收)。
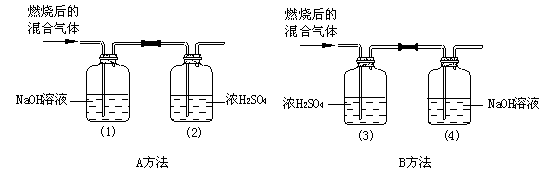
| 燃烧有机物的质量
| 实验方法
| 实验前后(1)-(4)装置质量 | |
| 实验前 | 实验后 | ||
| 甲同学:2.4 g | A
| (1)150 g | (1)160.2 g |
| (2)150 g | (2)151.8 g | ||
| 乙同学:2.4 g
| B
| (3)150 g | (3)155.4 g |
| (4)150 g | (4)156.6 g | ||
28.(8分)某课外活动小组拟用下面装置模拟一个生产过程,请据图回答以下问题:
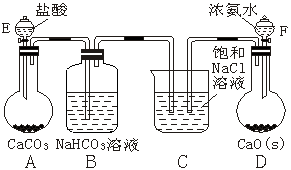
(1)打开F的活塞,瓶D中可产生一种气体,该气体是(写化学式) ▲ ;该反应的化学方程式为 ▲ 。
(2)瓶B的作用是 ▲ 。
(3)最终在烧杯C中结晶出一种晶体,该晶体滤出后,对其充分加热,该晶体分解,可得到一种白色粉末。烧杯C中反应的化学方程式为 ▲ 。
(4)该反应所得的产品产量和打开分液漏斗E、F的先后顺序有关,为了得到较高的产量应先打开分液漏斗 ▲ (选填“E”或“F”)
(5)若不考虑尾气的吸收问题,该装置C中有一处不太合理的地方,你认为应如何改进? ▲ 。
四、计算题(本大题共2小题,共10分)
29.(4分)若在200mL 0.5mol/L的Al2(SO4)3溶液中加入到一定体积的2mol/L的NaOH溶液,得到7.8 g Al(OH)3沉淀,则NaOH溶液的体积可能为 ▲ mL或 ▲ mL。
30.(6分)有一硫酸与硝酸的混合稀溶液,取出10.00 mL加入足量BaCl2溶液,过滤,洗涤,烘干后得到9.32g的沉淀;滤液与4.00 mol·L-1 NaOH溶液反应,用去22.50 mL碱液时恰好完全中和,请计算(列出计算过程):
(1)求原混合溶液中硫酸、硝酸的物质的量浓度。
(2)另取10.00 mL此混合溶液,加入3.20 g铜粉共热,求在标准状况下可收集到的气体的体积。