高二年级第一学期期中考试试题
化 学
注意事项:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写班级、学号和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只须上交答题卷。
可能用到的相对原子质量:
Cu-64 C-12 O-16 H-1 N-14
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有一个选项符合题意)
1.下列气体不会造成大气污染的是
A.SO2 B.N2 C.CO D.NO
2.下列含氮的氧化物中称为硝酸酸酐的是
A.NO B.N2O3 C.NO2 D.N2O5
3.能使湿润的红色石蕊试纸变蓝的气体是
A.Cl2 B.H2 C.NH3 D.HCl
4.常温下铁制容器可以盛放的试剂是
A.浓硝酸 B.稀硫酸 C.浓盐酸 D.硫酸铜溶液
5.下列气体只能用瓶口向下排空气法收集而不能用排水法收集的是
A.H2 B.NO C.NO2 D.NH3
6.下列试剂保存方法正确的是
A.浓HNO3放在广口瓶中 B.白磷放在煤油中
C.氨水放在密闭容器中 D.钠放在冷水中
7.当可逆反应:2SO2+O2![]() 2SO3已达到化学平衡时,充入少量18O2,一段时间后测定18O可能存在于
2SO3已达到化学平衡时,充入少量18O2,一段时间后测定18O可能存在于
A.O2中 B.O2和SO3中
C.SO2和SO3中 D.SO2、O2、SO3中
8.将下列固体在隔绝空气的密闭容器中用酒精灯加热,在加热过程中发生了化学反应,但冷却后又凝聚为原来物质的是
A.碘片 B.氯化铵 C.高锰酸钾 D.碳酸钠
9.下列物质的水溶液能导电,但属于非电解质的是
A.NaCl B.Cl2 C.Na2CO3 D.SO2
10.纯净的水呈中性,这是因为
A.纯水中C(H+)=C(OH-) B.纯水PH=7
C.纯水的离子积KW=1.0×10-14 D.纯水中无H+也无OH-
11.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成N2 和CO2 ,对此反应下列叙述中正确的是
A.使用催化剂不能改变反应速率 B.降低压强能使反应速率加快
C.改变压强对反应速率没有影响 D.升高温度能加快反应速率
12.合成氨反应的正反应是放热反应,则下面可以提高H2转化率的措施是
A.延长反应时间 B.充入过量氢气 C.充入过量氮气 D.升高温度
13.在一定条件下,对于密闭容器中进行的反应:P(g)+Q(g)![]() R(g)+S(g),下列说法中可以说明这一反应已经达到化学平衡状态的是
R(g)+S(g),下列说法中可以说明这一反应已经达到化学平衡状态的是
A.P、Q、R、S的浓度相等
B.P、Q、R、S在密闭容器中共存
C.P、Q、R、S的浓度不再变化
D.用P的浓度表示的化学反应速率与用Q表示的化学反应速率相等
14.下列叙述正确的是
A.强弱电解质的根本区别在于电离时是否存在电离平衡
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质的水溶液中只有离子,没有分子
D.强电解质融化状态下都能导电
15.用排水法收集12 mL NO于试管中,然后向倒立于水槽中的该试管内间歇地通入O2共12 mL,下面说法中,正确的是
A.剩余NO
B.剩余NO2
C.试管中气体为红棕色
D.试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体
16.关于氮族元素(用R代表)的下列叙述正确的是
A.最高化合价是+5 B.氢化物的通式为RH5
C.非金属性由上到下递增 D.其含氧酸均为一元强酸
17.从经济效益和环境保护考虑,大量制取硝酸铜最宜采用的方法是
A.Cu+HNO3(浓) →Cu(NO3)2
B.Cu+HNO3(稀) →Cu(NO3)2
C.![]()
D.Cu+AgNO3 →Cu(NO3)2
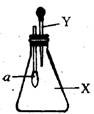 18.右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会可见小球a鼓起,气体X和液体y不可能是
18.右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会可见小球a鼓起,气体X和液体y不可能是
A.氨气和水
B.SO2和NaOH浓溶液
C.CO2和稀硫酸
D.氯化氢和NaNO3稀溶液
19.下列叙述正确的是
A.白磷难溶于水,也不能溶于CS2
B.红磷加热升华变成白磷是化学变化
C.白磷和红磷都是磷元素的同位素
D.磷的化学性质比氮气活泼,故磷的非金属性比氮强
20.增大压强,对已达平衡的下列反应 3P(g) + Q(g) ![]() 2R(g) + 2S(s)产生的影响是
2R(g) + 2S(s)产生的影响是
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都增大,平衡不发生移动
21.反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率为
4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率为
A.V(O2)=0.01 mol/(L·S) B.V(NO)=0.008 mol/(L·S)
C.V(H2O)=0.003 mol/(L·S) D.V(NH3)=0.004 mol/(L·S)
22.体积相同的甲、乙两个容器中,分别都充有等物质的量的NH3,在相同温度下,发生反应:2NH3![]() N2+3H2,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的转化率为p%,则乙容器中NH3的转化率为
N2+3H2,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的转化率为p%,则乙容器中NH3的转化率为
A.等于p% B.小于p% C.大于p% D.无法判断
23.将38.4克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体22.4L(标况下),则所消耗硝酸的物质的量是
A.0.11mol B.0.22mol C.1.6mol D.2.2mol
二、填空题:(本题计4小题,共28分)
24.(4分)
完成并配平下列化学方程式:
(1) FeO + HNO3 —— Fe(NO3)3 + NO ↑ + ;
(2) P4 + OH- + H2O —— PH3 + H2PO4-
25.(6分)
分别将盛有浓盐酸、浓硫酸、浓硝酸的烧杯露置于空气中,放置一段时间后,质量增大的是__________,原因是________________________________________________;质量减小的是 原因是_________________________________________。
26.(4分)
久置的浓硝酸变黄的原因是________________________ ______________,反应的化学方程式为 。
27.(8分)
在盛稀硫酸的试管中,加入一小块铜片后,观察不到明显的现象。然后再加入适量硝酸钾晶体并微热,可观察到的现象是① ,② ,③ 。写出反应的离子方程式 。
28.(6分)
硝酸可使许多种非金属氧化,例如把一红热木炭放到浓硝酸中,可有剧烈反应,化学方程式为_________________________ ;
(1)把产生的气体直接通入石灰水中现象________________________________。
(2)把产生的气体经水洗后再导入澄清的石灰水中,可以观察到的现象是__ 。
三、实验题: (本大题共1小题,15分)
29.某同学在实验室制氨气时进行下列实验设计。
(1)实验室制氨气的原理(写化学方程式): ,氨气的电子式为: ,氨气分子的空间构型是: 。
(2)实验室制氨气的发生装置与制 气体完全相同。(填化学式)
(3)将制备的氨经 干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)
。
四、计算题:(本大题共2小题,共11分)
30.(6分)
在一定温度下,发生如下反应: N2 +3H2 ![]() 2NH3 起始时充入的N2 和 H2 的物质的量分别是3.0 mol和6.0 mol,平衡时,生成NH3的物质的量是2.4 mol.已知容器的容积为5.0 L,试求:
2NH3 起始时充入的N2 和 H2 的物质的量分别是3.0 mol和6.0 mol,平衡时,生成NH3的物质的量是2.4 mol.已知容器的容积为5.0 L,试求:
(1)H2 的转化率.
(2)平衡时混合气体中N2 的体积分数.
31.(5分)
氨氧化法制硝酸的生产过程中,如果由氨制一氧化氮的转化率为96% ,而一氧化氮转化为硝酸的产率为92% 。现用10 t 氨按上述情况可制得50%的硝酸多少吨?
化学参考答案
一、选择题(共23题,每题2分,共46分。每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | D | C | A | D | C | D | B | D | A | D | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | C | A | D | A | C | C | B | C | C | C | D |
|
二、填空题(本题计4小题,共28分)
24.(4分)
完成并配平下列化学方程式:
(1) 3 FeO + 10 HNO3 == 3 Fe(NO3)3 + 1 NO↑ + 5 H2O ;
(2) 2 P4 + 3 OH- + 9 H2O == 5 PH3 + 3 H2PO4-
25.(6分)
质量增大的是_浓硫酸__,原因是浓硫酸具有吸水性_;
质量减小的是 浓盐酸、浓硝酸 原因___浓盐酸、浓硝酸是挥发性酸。
26.(4分)
原因是_浓硝酸分解生成的红棕色的二氧化氮气体溶于硝酸_,
反应的化学方程式为 4HNO3== 4NO2+O2+H2O。
27.(8分)
观察到的现象是① 铜溶解 ,② 溶液变蓝色 ,③ 有红棕色气体生成 (产生红棕色气体,经一段时间产生无色气体),
离子方程式 3Cu+8H++2NO3==3Cu3++2NO+4H2O。
28.(6分)
化学方程式为 ![]() ;
;
(1)___无现象__________;
(2)__有白色沉淀产生 。
三、实验题: (本大题共1小题,15分)
29.(1)实验室制氨气的原理(写化学方程式):
![]() ,氨气电子式为: 略
,
,氨气电子式为: 略
,
氨气分子的空间构型是: 三角锥形 。
(2) O2 。(填化学式)
(3)氨经 碱石灰 (名称)干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)
![]()
![]()
![]()
![]() 。
。
三、计算题(本大题共2小题,共11分)
30.(6分)
(1) 60% (2) 27%
31.(5分)
65(t)