高二年级化学月考试题
本试卷分选择题和非选择题两部分,满分150分,考试用时120分钟。
第一部分 选择题(共80分)
一.单项选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意)
1.在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
2.下列说法正确的是
A.增大反应物浓度,可增加活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
3.过程的自发性的作用是
A.判断过程的方向 B.确定过程是否一定会发生
C.判断过程发生的速率 D.判断过程的热效应
4、下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
5、下列溶液中导电性最强的是( )
A.![]() 醋酸 B.
醋酸 B.![]() 溶液
溶液
C.![]() 盐酸
D.
盐酸
D.![]() 溶液
溶液
6.一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
7.在一定温度不同压强(P1<P2)下,可逆反应2X(g) ![]() 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
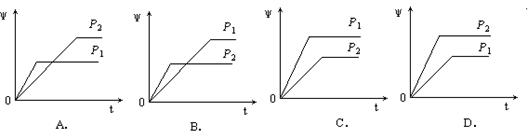
8.α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
9、氨水中所含有的分子和离子有( )
①![]() ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
10、下列物质属于电解质的是( )
A. Cu B. 液态NH3 C. CO2 D. Na2O2固体
二. 不定项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若该题只有一个正确选项,多选时该题为0分,只有答对才给4分;若该题有两个正确选项,只选一个且正确时给2分,选两个且都正确时给4分。)
11.在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量 B.升高温度
C.增大压强 D.使用正催化剂
12. 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)
![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向正反应方向移动
D. 物质C的质量分数增大
|
|
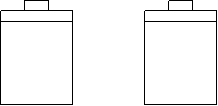 13.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:
13.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:
(N2O4![]() 2NO2 △H
> 0)
2NO2 △H
> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
14、下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3=Ca2++CO32-
15、下列离子在溶液中能大量共存的是( )
A. Cu2+ Na+ NO![]() S2- B. Mg2+ H+ SO
S2- B. Mg2+ H+ SO![]() NO
NO![]()
C. Al3+ Na+ HCO![]() SO
SO![]() D. Fe3+ H+ SCN- Cl-
D. Fe3+ H+ SCN- Cl-
16、能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是( )
A.将水加热煮沸,测得pH=6 B.向纯水中投入一小块金属钠
C.向水中加入NH4Cl固体 D.向水中加入Na2CO3固体
17、某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
18、pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
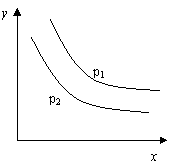 19.反应:L(s)+aG(g)
19.反应:L(s)+aG(g)![]() bR(g) 达到平衡时,
bR(g) 达到平衡时,
温度和压强对该反应的影响如图所示:图中压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a<b
20.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在101KPa ,1mol纯物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
D.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
第二部分 非选择题(共70分)
三、实验题(本题包括3小题,共22分)
21.(8分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据(1)弱碱在水中存在电离平衡。(2)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(1)的实验方法及现象_____________________。
(2)应用根据(2)的实验方法及现象_____________________。
 22.(4分)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
22.(4分)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
 |
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是 ( )
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
23.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
_____________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪
些假设或猜想(列出两种即可)?
假设一:________________________________________________________________________
假设二:________________________________________________________________________
四、填空题(共48分)
24、(9分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_______________________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
25、(4分)把AlCl3 溶液蒸干后再灼烧,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)____________________________
_____ __。
26、(6分)在0.2mol/L氨水中存在着下列平衡:NH3+ H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-,当改变条件时,表中各项内容有何变化:
NH4+ +OH-,当改变条件时,表中各项内容有何变化:
| 改变条件 | 平衡移动方向 | PH值 | C(NH4+) |
| 通入氨气至饱和 | |||
| 加入少量盐酸 | |||
| 加入少量NH4Cl | |||
| 加水稀释 |
27.(16分)
(1)(6分)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
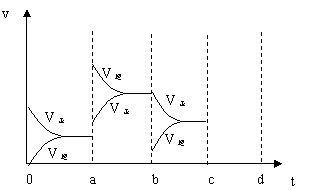 (2)(6分)下图左表示在密闭容器中反应:2SO2+O2
(2)(6分)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.
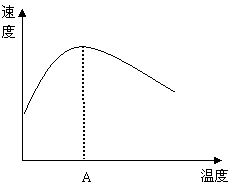 (3)(4分)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
(3)(4分)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
解释曲线变化原因
。
28.(7分反应m A+n
B![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是
______ _________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
29.(6分)某温度下SO2的转化反应的平衡常数K =532.4,2SO2+O2 ![]() 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。