高二年级化学秋季期中联考试卷
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分110分,考试时间120分钟
注意事项:
答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要求填在答题纸上,非选择题的答案写在答题纸上对应题目的答案空格内,答案不写在试卷上。考试结束后,将答题纸交回。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 Ca40
Fe56 Cu64
第I卷(选择题,共60分)
一、选择题(本题包括20小题,每小题3分,共60分,每小题均有一到两个选项符合题意)
1.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.HClO B.Cl2 C.NH4HCO3 D.SO2
2.下面是合成氨的简要流程示意图:
|
|
|
 |
沿x路线回去的物质是 ( )
A.N2和H2 B.催化剂 C.N2 D.H2
3.可逆反应N2(g)+3H2(g)![]() 2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
2NH3(g)的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
A.3ν正(N2)= ν正(H2) B.ν正(N2)= ν正(NH3)
C.2ν正(H2)=3 ν正(NH3) D.ν正(N2)=3ν 逆(H2)
4.在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是( )
A. Z为0.3mol/L B. Y2为0.35mol/L C. X2为0.2mol/L D. Z为0.25mol/L
5.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其中pH值 依次为8、9、10,则HX、HY、HZ 的酸性由强到弱的顺序是 ( )
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D. HY、HX、HZ
6.一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量CO32-的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、S2-、SO42-、Cl-
7.在H2S溶液中,采取一些方法使pH增大,则c(S2-)的变化情况是 ( )
A.增大 B.减小
C.可能增大也可能减小 D.不变
8.某科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
![]()
![]()
![]()
![]()
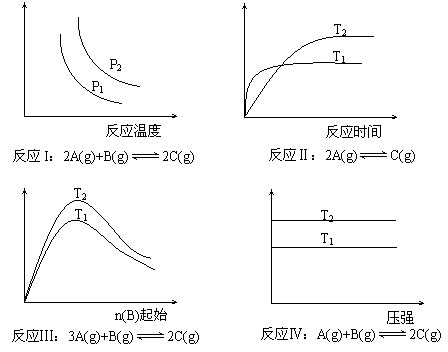
根据以上规律判断,下列结论正确的是 ( )
A.反应I:正反应吸热,P2>P1
B.反应Ⅱ:正反应放热,T1>T2
C.反应Ⅲ:正反应吸热,T2>T1;或正反应放热T2<T1
D.反应Ⅳ:正反应放热,T2>T1
9.下列反应的离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.碘化亚铁溶液中通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
10.在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
11.在O.1mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+。对于该平衡,下列叙述正确的是
( )
CH3COO-+H+。对于该平衡,下列叙述正确的是
( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C滴加少量0.1mol·L-1HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
12.某温度下,在固定容积的容器中,可逆反应A (g) + 3B (g)![]() 2C (g) 达到平衡,此时测得n(A) :n(B) :n(C) = 2 :2 :1,保持温度不变,以n(A) :n(B) :n(C) = 2 :2 :1的比例向该容器再充入A、B和C,则( )
2C (g) 达到平衡,此时测得n(A) :n(B) :n(C) = 2 :2 :1,保持温度不变,以n(A) :n(B) :n(C) = 2 :2 :1的比例向该容器再充入A、B和C,则( )
A.平衡向正反应方向移动 B.平衡向逆反应方向移动
C.平衡不发生移动 D.n(A)减小
13.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离出的OH-离子浓度之比为 ( )
A.1010:1 B.5×109:1 C.108:1 D.1:1
|
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+2c(C2O42-)
15.恒温恒容条件下,2A(g) ![]() B(g),达到化学平衡,再向容器中通入一定量的A或者B,又重新达到平衡,新的平衡体系与旧的平衡体系比较,A的体积分数
( )
B(g),达到化学平衡,再向容器中通入一定量的A或者B,又重新达到平衡,新的平衡体系与旧的平衡体系比较,A的体积分数
( )
A.都减小 B.都增大
C.通入A的减小,通入B的增大 D.通入B的减小,通入A的增大
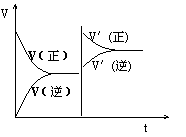 16.对于已知平衡时的可逆反应x+ y
16.对于已知平衡时的可逆反应x+ y![]() z+w 增大压强正逆反应速率的图象如下:
z+w 增大压强正逆反应速率的图象如下:
分析图示可知关于x、y、z、w物质的聚集状态是下列的 ( )
A.z、w均为气体,x、y中只有一种是气体
B.z、w中有一种是气体,x、y皆非气体
C.x、y、z皆为气体,w非气体
D.x、y均为气体,z、w中有一种是气体
17.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10mL0.02mol·L-1HCl溶液与10mL0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL。则溶液的pH=12(25℃)
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.在0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
18.一定条件下,可逆反应X(g) + 3Y (g)![]() 2Z (g) 进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为
( )
2Z (g) 进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为
( )
A.1:3 B.3:1 C.1:1 D.1:2
19.现在分开盛放的M和N两种溶液,各含有下列十四种离子中的七种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、SO42-、AlO2-、CO32-,且两种溶液中所含离子各不相同,已知M溶液里的阳离子只有两种,则N溶液里的阴离子是 ( )
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.NO3-、Cl-、SO42- D.AlO2-、SO42-、MnO4-
20.已知:反应H2A+B-(足量)=HA-+HB和H2A+2C-(足量)=2HC+A2-,则下列说法正确的是( )
A.若将pH=3的H2A的溶液和pH=11的NaOH溶液等体积混合,则溶液呈酸性
B.HA-、B-、C-、A2-得质子能力由强到弱得顺序为C->A2->B->HA-
C.HC和B-间可发生反应:HC+B-=HB+C-
D.物质的量浓度均为1mol·L-1的HB溶液和NaOH溶液等体积混合后,溶液呈酸性
化学试卷答卷
第I卷(选择题,共60分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
第Ⅱ卷(非选择题,共50分)
21.(12分)已知某溶液中只存在OH—、H+、NH4+、Cl—四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中
c(OH-)的关系c(H+) c(OH-)。
22.(4分)在如图所示的三个容积相同的容器①、②、③中进行如下的反应:
 3A(g)+B(g)
3A(g)+B(g)![]() 2C(g)
(正反应放热)
2C(g)
(正反应放热)

| |
| |
充入3molA和1molB,则达到平衡时
各容器中C物质的百分含量由大到小
的顺序为_______________________
(填容器编号) ①外有隔热套 ② ③活塞可移动
(不考虑活塞质量和摩擦系数)
(2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3 molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
23.(11分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,还应该进行的操作是_____________________________。
(2)下面是碱式滴定管中液面在滴定前后的读数,c(HCl)=_______________________。
 (3)若在滴定前滴定管尖嘴部分留有气泡,滴定
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定
后滴定管尖嘴部分气泡消失,则滴定的HCl
物质的量浓度会偏______________。
(4)某学生用准确配制的0.2mol·L-1的盐酸通过
中和滴定方法来测定某NaOH和Na2CO3混合液中
两种溶质的物质的量浓度。设计以下两个实验方案:(已知指示剂发生颜色变化的pH范围分别是:甲基橙:3.1-4.4,酚酞:8.2-10。常温下,二氧化碳饱和溶液的pH约为3.9)
【方案I】:①取混合溶液VmL,加入足量的BaCl2溶液后,以酚酞为指示剂,用上述盐酸滴定,到终点时耗用盐酸V0mL;
②再另取混合溶液VmL,以甲基橙为指示剂,用上述盐酸滴定,到终点时,耗用盐酸V1mL。
【方案Ⅱ】:操作方法与方案I相同,但①②两过程所用的指示剂作了调换,即①用甲基橙为指示剂,②用酚酞为指示剂。
假设以上操作都是准确的,试判断两个方案是否合理:方案I___________,方案Ⅱ__________。
根据合理的方案计算出Na2CO3物质的量浓度的数学表达式_______________________________。
24.(8分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
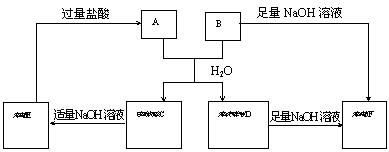 (1)无色溶液F中,一定含有的溶
(1)无色溶液F中,一定含有的溶
质的化学式为____________。
(2)写出白色胶状沉淀C转化为
无色溶液E的离子方程式
________________________。
(3)A和B的混合物溶于水发生
反应的离子方程式_____________
____________________________。
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式_________________________________________________________。
25.(10分)某温度( t℃)时水的离子积为1×10-13,则该温度(选填大于、小于或等于)_____25℃,其理由是___________________________。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(混合后体积变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a:b=__________;此溶液中各种离子浓度由大到小排列顺序是
______________________________________________。
(2)若所得混合液的pH=2,则a:b=_____________;此溶液中各种离子浓度由大到小排列顺序是
______________________________________________。
26.(5分)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) ![]() CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
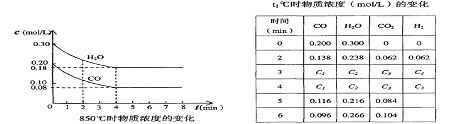
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
化学试卷参考答案
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | D | A | C | C | C | A | C | BC | BD | B |
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 | B | A | C | C | A | D | BC | D | B | AB |
21.(每空2分)(1)NH4C1 ① (2)NH4Cl和NH3·H2O ;NH4Cl和HC (3)小于,大于
22.(每空2分)(1)③②① (2)大于
23.(1)标准碱液润洗(1分) (2)![]() (2分) (3)大(2分)
(2分) (3)大(2分)
(4)合理(1分) 不合理(1分) 0.1(V1-V0)/V mol·L-1(4分)
24.(1)Na2CO3(1分) (2)Al(OH)3+NaOH=NaAlO2+2H2O (2分)
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑ (2分)
(4)有白色胶状沉淀(1分) AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-(2分)
25. 大于(1分) 温度升高,水的离子积增大(1分)
(1)10:1(2分) c(Na+)>c(SO42-)>c(H+)=c(OH-)(2分)
(2)9:2(2分)c(H+)>c(SO42-)>c(Na+)>c(OH-)(2分)
26.(每空1分) 0.03 ①平衡 > ②d a