高二年级化学第一学期期中联考题
化 学 试 题
YCY
本试卷分为I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间100分钟.
可能用到的相对原子质量:
Na:23 H:1 C:12 O:16
第Ⅰ卷(选择题,共50分)
一、选择题(每题只有一个答案,每题2分,共20分)
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是 ( )
A.Mg2+ B.Ca2+ C.Na+ D.Fe3+
2.下列物质的水溶液,其pH小于7的是 ( )
A.Na2CO3 B.NH4NO3 C.NaClO D.KNO3
3.下列各方程式中,属于水解反应的是 ( )
![]()
![]() A.CO2+H2O H2CO3 B.OH-+HS- S2-+H2O
A.CO2+H2O H2CO3 B.OH-+HS- S2-+H2O
![]()
![]() C.HS-+H2O H3O++S2- D.S2-+H2O HS-+OH-
C.HS-+H2O H3O++S2- D.S2-+H2O HS-+OH-
4.下列说法不正确的是 ( )
A.任何化学反应都伴随有能量变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.反应物的总能量低于生成物的总能量时,发生吸热反应
5.某温度时,都是1mol/L的两种气体X2和Y2在密闭容器中发生反应生成气体Z,经5s后
测知X2、Y2和Z的浓度依次为0.4mol/L、0.8mol/L、0.4mol/L,1min后达到平衡。则该
反应的化学方程式用X、Y可表示为 ( )
![]()
![]() A.X2+2Y2 2XY2 B.2X2+Y2 2X2Y
A.X2+2Y2 2XY2 B.2X2+Y2 2X2Y
![]()
![]() C.X2+3Y2 2XY3 D.3X2+Y2 2X3Y
C.X2+3Y2 2XY3 D.3X2+Y2 2X3Y
6.增大压强,对已达到平衡的下列反应产生的影响是 ( )
![]() 3X(g)+Y(g)
2Z(g)+2Q(s)
3X(g)+Y(g)
2Z(g)+2Q(s)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
7.在溶液中能大量共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B.Cu2+、K+、OH-、NO3-
C.Al3+、Ba2+、HCO3-、Cl- D.H+、Fe2+、Cl-、NO3-
![]() 8.在稀氨水中存在平衡:NH3·H2O NH4++OH-,要使用NH3·H2和NH4+的浓度都增
8.在稀氨水中存在平衡:NH3·H2O NH4++OH-,要使用NH3·H2和NH4+的浓度都增
大, 应采取的措施是 ( )
A.加NaOH溶液 B.加NH4Cl固体
C.加盐酸 D.加NaCl溶液
9.已知1.2gC(石墨)不完全燃烧生成CO,放出11.1kJ热量,继续燃烧又放出28.3kJ热量。
则能表示C(石墨)燃烧热的热化学方程式为 ( )
A.C(石墨)+1/2O2(g)====CO(g); △H=-11.1kJ·mol-1
B.C(石墨)+1/2O2(g)====CO(g); △H=-111.1kJ·mol-1
C.C(石墨)+O2(g)====CO2(g); △H=-394kJ·mol-1
D.C(石墨)+O2(g)====CO2(g); △H=-283kJ·mol-1
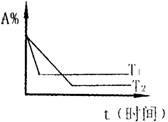
![]()
|
A.T1>T2,正反应是放热反应
B.T1>T2,正反应是吸热反应
C.T2>T1,正反应是放热反应
D.T2>T1,正反应是吸热反应
二、选择题(每题1—2个正确答案,
部分做对1分,每小题3分,共30分)
![]() 11.在一定温度下,可逆反应X(气)+3Y(气) 2Z(气)达到平衡的标志是 ( )
11.在一定温度下,可逆反应X(气)+3Y(气) 2Z(气)达到平衡的标志是 ( )
A.单位时间生成amolX,同时生成3a molY
B.Z生成的速率与Z分解的速率相等
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数之比为1:3:2
12.在25℃时,某溶液中由水电离出的c(H+)=1×10-12mol/L,则该溶液的pH可能是( )
A.12 B.7 C.6 D.12
13.下列说法正确的是 ( )
A.酸式盐的溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为中氢离子物质的量浓度和氢氧根离子物质的量浓度相等
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
14.下列说法中不正确的是 ( )
A.从平衡常数的大小可以推断反应进行的程度
B.K值越小,反应物的转化率越大
C.K值越大,反应物的转化率越大
D.温度越高,K值越大
15.下列说法中正确的是 ( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
16.下列说法正确的是 ( )
A.相同温度下,1mol·L-1氨水溶液与0.5mol·L-1氨水溶液中,[OH-]之比是2:1
B.0.1mol·L-1NH4Cl溶液中的[NH4+]=[Cl-]
C.向0.1mol·L-1NaNO3溶液中滴加稀盐酸,使溶液的pH=5,此时混合液中[Na+]=[NO3-]
D.向醋酸钠溶液中加入适量醋酸,使混合液中的pH=7,此时混合液中[Na+]=[CH3COO-]
17.在101kPa和25℃时,有反应的热化学方程式:H2(g)+1/2O2(g)=H2O(g);
△H=-241.8kJ/mol,H2(g)+1/2O2(g)=H2O(1);△H=-285.8kJ/mol。下列说法中错误的是
( )
A.H2燃烧生成 1mol H2O(g)时,放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1mol 流态水变成水蒸气时吸收44kJ的热量
![]() 18.某温度下,在容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
18.某温度下,在容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1 mol
19.在10 mL 0.1mol/L的NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.C(Na+)=c(Ac-)+c(HAc) B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)>c(Ac-)>c(OH+)>c(OH-) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
20.将ag含NaOH样品溶解在bmL0.1mol·L-1的硫酸中,再加入cmL0.1mol·L-1的氢氧化钡溶液。反应后所得溶液恰好呈中性,则样品中NaOH的纯度是 ( )
A.[(b-c)/125a]×100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100%
第Ⅱ卷(非选择题,共50分)
三、填空题(共24分)
21.按要求写离子方程式
(1)CH3COOH和NH3·H2O中和
(2)H2O电离;H2O+H2O
(3)Na2CO3水解
22.(1)据了解,我国兴建的三峡工程提供的水力发电功率相当于3000万kW的火力发电站。因此,三峡建设将有助于控制 ( )
A.温室效应 B.白色污染
C.城市污水的任意排放 D.长江中、下游的洪涝灾害
(2)已知1g碳粉在氧气中完全燃烧放出的热量是32.8kJ(与1g原煤相当),试写出相关的热化学方程式: 。
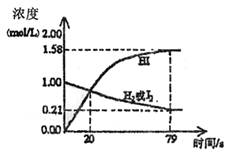
|
(1)写出反应的化学方程式 。
(2)以上反应在425℃,1L密闭容器中达到平衡时所用的时间是 。
(3)用HI表示反应从开始至达到平衡时反应的平均速率 。
24.反煤作为燃料可以通过以下两种途径:
途径I:C(s)+O2(g)=CO2(g);△H1<0。
途径Ⅱ:先制水煤气C(s)+H2O(g)=CO(g)+H2(g); △H2>0,
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);△H3<0,
2H2(g)+O2(g)=2H2O(g); △H3<0。
请回答下列问题。
(1)判断两种途径放热:途径1放出的热量 (填“大于”、“等于”或“小于”)途径II放出的热量
(2)由于制取水煤气反应里,反应物具有的总能量 (填“大于”、“等于”或“小于”)生成物具有总能量,那么在化学反应时,反应物就需要 (填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是 。
(3)△H1、△H2、△H3和△H4的数学关系式是 。
四、实验题(共15分)
25.请根据以下实验内容填写实验报告(实验现象、实验解释或实验结论)
(1)以下实验均在室温下进行
| 实验内容 | 混合溶液的pH(填>、<或=) | 实验解释(用化学方程式或离子方程式和简要文字说明) |
| ①0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合 | pH 7 | |
| ②Ph=1CH3COOH溶液与pH=13NaOH溶液等体积混合 | pH 7 |
![]() (2)研究外界条件对化学平衡FeCl3+3KSCN Fe(SCN)3+3KCl的影响,特进行以下实验,请填写实验报告。先将FeCl3溶液与KSCN溶液各2滴加入10mL水中,充分混合均匀,会看到的现象为
。再将上述溶液分装在3支试管中,其中一支留作对比,向另外2支试管中分别进行如下操作,试填写下表的实验报告。
(2)研究外界条件对化学平衡FeCl3+3KSCN Fe(SCN)3+3KCl的影响,特进行以下实验,请填写实验报告。先将FeCl3溶液与KSCN溶液各2滴加入10mL水中,充分混合均匀,会看到的现象为
。再将上述溶液分装在3支试管中,其中一支留作对比,向另外2支试管中分别进行如下操作,试填写下表的实验报告。
| 外界条件的改变 | 实验现象 | 实验结论 |
| ①加入少量NaOH溶液 | ||
| ②再加入几滴FeCl3溶液 |
五、计算题(共11分)
26.中和相同体积、相同pH的Ba(OH)2、NaOH、NH3·H2O三种溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则V1 V2 V3(填>,=或<)。
![]() 27.反应N2+3H2 2NH3在固定容积的密闭容器中进行并达到平衡状态,此时c(N2)=3.5mol/l,c(H2)=11mol/L,c(NH3)=5mol/L.
27.反应N2+3H2 2NH3在固定容积的密闭容器中进行并达到平衡状态,此时c(N2)=3.5mol/l,c(H2)=11mol/L,c(NH3)=5mol/L.
求:(1)该温度下,反应的平衡常数是多少 ?
(2)N2和H2的起始浓度。
(3)N2的转化率。
参考答案及评分标准
第Ⅰ卷(选择题,共50分)
一、选择题(每题2分,共20分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | C | B | D | B | D | C | A | B | C | A |
二、选择题(每题3分,共30分,部分做对1分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | BC | AD | C | BD | D | CD | B | C | C | A |
第Ⅱ卷(非选择题,共50分)
三、填空题(共24分)
21.(1)CH3COOH+NH3·H2O=CH3COO-+NH4+………………………………(2分)
![]() (2)H2O+H2O H3O++OH-………………………………………………(2分)
(2)H2O+H2O H3O++OH-………………………………………………(2分)
![]()
![]() (3)CO32-+H2O CHO3+OH- HCO3-+H2O H2CO3+OH…… (2分)
(3)CO32-+H2O CHO3+OH- HCO3-+H2O H2CO3+OH…… (2分)
22.(1)AD…………………………………………………………………………(2分)
(2)C(s)+O2(g)=CO2(g) △H=-393.6FJ/mol………………………………(2分)
![]() 23.(1)H2+I2 2HI (2)79s (3)0.02mol/(L·S)……………(2分×3分=6分)
23.(1)H2+I2 2HI (2)79s (3)0.02mol/(L·S)……………(2分×3分=6分)
24.(1)等于…………………………………………………………………………(2分)
(2)小于、吸收、加热(3×1分=3分)
(3)![]() …………………………………………(3分)
…………………………………………(3分)
四、实验题(共15分)
25.(1)①pH>7;CH3COOH+NOOH=CH3COONa+H2O 反应物恰好反应生成CH3COONa、
![]() CH3COONa CH3COOH+NaOH,CH3COONa水解,溶液显碱性,pH>7
CH3COONa CH3COOH+NaOH,CH3COONa水解,溶液显碱性,pH>7
………………………………………………………………………………(1分+3分)
pH<7;CH3COOH+NaOH=CH3COONa+H2O,PH=1CH3COOH溶液中,
![]() (CH3COOH)>0.1mol/L,反应后CH3COOH过量许多,溶液主要是CH3COOH电离;CH3COOH CH3COO-+H+ ②,使溶液pH<7…………………………(1分+3分)
(CH3COOH)>0.1mol/L,反应后CH3COOH过量许多,溶液主要是CH3COOH电离;CH3COOH CH3COO-+H+ ②,使溶液pH<7…………………………(1分+3分)
(2)溶液变为红色………………………………………………………………(1分)
①溶液红色褪去生成红褐色沉淀…………………………………………(1分)
![]() Fe3++3OH-=Fe(OH)3↓ FeCl3+3KSCN Fe(SCN)3+3KCl其它条件不变,减小反应物浓度,平衡向逆反应方向移动。……………………………………(2分)
Fe3++3OH-=Fe(OH)3↓ FeCl3+3KSCN Fe(SCN)3+3KCl其它条件不变,减小反应物浓度,平衡向逆反应方向移动。……………………………………(2分)
②溶液颜色加深;…………………………………………………………(1分)
![]() FeCl3+3KSN Fe(SCN)3+3KCl其它条件不变,增大反应物浓度,平衡向正反应方向移动。……………………………………………………………………(2分)
FeCl3+3KSN Fe(SCN)3+3KCl其它条件不变,增大反应物浓度,平衡向正反应方向移动。……………………………………………………………………(2分)
五、计算题:(共11分)
26.V1=V2<V3…………………………………………………………(2分×2分=4分)
27.解:(1)![]() ………………(2分)
………………(2分)
设起始时C(N2)=a C(H2)=b
![]() N2 + 3H2 2NH3
N2 + 3H2 2NH3
起始浓度(mol/L) a b 0
转化浓度(mol/L) 2.5 7.5 5
平衡浓度(mol/L) 3.5 11 5…………………………(2分)
(2)C(N2)=a=2.5mol/L+3.5mol/L=6mol/L………………………………………(1分)
C(H2)=b=11mol/L+7.5mol/L=18.5mol/L……………………………………(1分)
(3)N2的转化率=![]() ×100%=41.7%………………………………………(1分)
×100%=41.7%………………………………………(1分)