高二年级化学第一次阶段测试试题
第Ⅰ卷(选择题 共60分)
(时间:100分钟,分值:120分)
一、选择题(本题包括15小题,每题3分,共45分。每小题只有一个正确选项)
1. 已知反应A+B= C+D为放热反应,,对该反应的下列说法中正确的
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的能量总和一定高于C和D的能量总和
D. 因该反应为放热反应,故不必加热就可自发进行
2、决定化学反应速率的主要原因是 ( )
A.参加反应物质的性质 B.加入催化剂
C.温度和压强 D.各反应物和生成物的浓度
3、已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A、H2O(l)=H2(g)+![]() O2(g);
O2(g);![]() H= +242kJ·mol-1
H= +242kJ·mol-1
B、2H2(g)+O2(g)+2H2O(l);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
C、H2(g)+![]() O2(g)=H2O(g);
O2(g)=H2O(g);![]() H= +242kJ·mol-1
H= +242kJ·mol-1
D、2H2(g)+O2(g)=2H2O(g);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
![]() 4、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温恒容下已达到平衡的是
4、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温恒容下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内 的气体密度不随 时间变化
![]() 5. 在一定条件下,反应2HI(g) H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,有以下措施: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度
⑥减小压强,其中可采取的有 ( )
5. 在一定条件下,反应2HI(g) H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,有以下措施: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度
⑥减小压强,其中可采取的有 ( )
A、1种 B、2种 C、3种 D、4种
6、反应:X(g) + 3Y(g) ![]() 2Z(g)
2Z(g) ![]() H﹤0,在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为( )
H﹤0,在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为( )
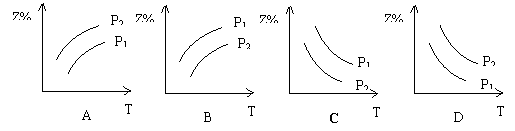 |
7、在密闭容器里,A与B反应生成C,其反应速率分别用![]() 、
、![]() 、
、![]() 表示,已知2
表示,已知2![]() =3
=3![]() 、3
、3![]() =2
=2![]() ,则此反应可表示为( )
,则此反应可表示为( )
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
8、在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
9.下列关于化学反应方向的说法中,正确的是:
A. 通常情况下,放热反应可以自发进行,而吸热反应则不能自发进行
B. 熵是描述体系混乱度的一个物理量,化学反应过程中,物质的熵变有增有减,熵变增加,则反应可自发进行,熵变减小,则反应不能自发进行。
C.化学反应能否自发进行,与反应焓变和熵变有关。当△H—T△S >0时,反应非自发。
D.通常 ,既可向正方向进行,又能向逆方向进行的反应,一定是可逆反应。
10. 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
11.
在2A+B![]() 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
12. 已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
A.升高温度,正向反应速率减小,逆向反应速率增大
B.升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
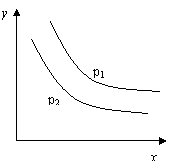 13. 反应:L(s)+aG(g)
13. 反应:L(s)+aG(g)![]() bR(g) 达到平衡时,
bR(g) 达到平衡时,
温度和压强对该反应的影响如图所示:图中压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a +1<b
![]() 14、在一定条件下反应x A + y B z C达到平衡。下列说法中正确的是( )
14、在一定条件下反应x A + y B z C达到平衡。下列说法中正确的是( )
A.若C是气体,且x + y = z ,则增大压强平衡一定不移动
B.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x + y < z
C.若B、C都是气体,其它条件不变,增大A的物质的量平衡不移动,则A为固态或液态
D.若升高温度C的质量分数减少,则正反应是吸热反应
15、某恒温恒容容器中,建立如下平衡:2A(g)![]() B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
( )
B(g),在相同条件下,若分别向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
( )
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
二. 选择题(本题包括5小题,每小题3分共15分。每小题有1~2个正确选项。若只包含一个正确选项,多选时该题0 分;若正确答案有2个选项,只选一个且正确给1分,选2个且都正确给3分,但只要选错一个,该小题就为 0分)
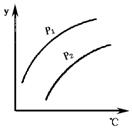 16.如图表示不同温度和压强下,对可逆反应2L(气)
16.如图表示不同温度和压强下,对可逆反应2L(气) ![]() 2M(气)+N(气);△H>0平衡状态的影响
p1<p2,图中y轴表示的意义是
( )
2M(气)+N(气);△H>0平衡状态的影响
p1<p2,图中y轴表示的意义是
( )
A.一定条件下L的转化率 B.气体混合物中M的体积分数
C.气体混合物中L的体积分数 D.气体混合物的平均摩尔质量
![]() 17、对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
17、对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
 | |||||
| |||||
|
|
|
18、对于某一已经建立平衡的可逆反应,当条件改变或采取某些措施时使平衡向正反应方向移动,以下叙述正确的是 ( )
①生成物的质量分数一定增大 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂
A. ①②③ B. ②④⑤ C. ③④⑤ D.②⑤
19、T °C时A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(2)所示。则下列结论正确的是 ( )
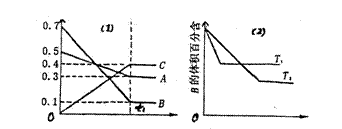
图(1) 图(2)
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡向逆反应方向移动。
B.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.T °C若由0.4mol/L A、0.4mol/L B、0.2mol/L C反应、达到平衡后,C的浓度仍为0.4mol/L
D.(t1+10)min保持压强不变,通入稀有气体,平衡向正反应方向移动
20、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应∶
A(g)+2B(g)![]() 2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是 ( )
2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是 ( )
A.原混合气体的体积为1.5V
B.原混合气体的体积为1.25V
C.反应达到平衡时,气体A消耗了0.5V
D.反应达到平衡时,气体B消耗了0.5V
第Ⅱ卷(非选择题,共60分)
三、(本题包括4小题, 共16分)
21、(6分)发射“神州六号”载人飞船的长征火箭是用肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g) △H = 67.7 kJ·mol-1;
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =-534 kJ·mol-1;
肼与二氧化氮反应的热化学方程式为 。
已知下列反应 :
H2(g)=2H(g) ΔH1=+Q1 kJ/mol
O2(g)=2O(g) ΔH2=+Q2 kJ/mol
2H(g)+O(g)=H2O(g) ΔH3=-Q3 kJ/mol
H2O(g)=H2O(l) ΔH4=-Q4 kJ/mol
H2(g)+ 1/2O2(g)=H2O(l);ΔH5=-Q5 kJ/mol
试指出Q1、Q2、Q3、Q4、Q5的等量关系:
22. (6分)反应m A+n B![]() p C在某温度下达到平衡状态。
p C在某温度下达到平衡状态。
①若升高温度,A物质的转化率增大,该反应为 热反应。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
23. (12分)将气体A、B置于容积为2L的密闭容器,发生如下反应:
4A(g)+B(g)![]() 2C(g)
2C(g)
反应进行到10S末达到平衡状态时:测得容器内有A为0.6mol,B为0.4mol,C为0.2mol,
(1)则vA= _____________ vB= _________________ vC= ______________
(2)反应前A有 ___ mol,反应前B有 _____ mol
⑶达到平衡状态时,A物质的转化率为 。
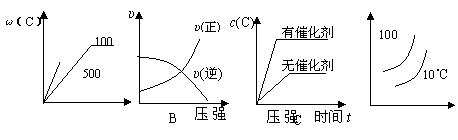
24、(16分)右图是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[υ(NO)]的实验装置图。试回答下列问题:
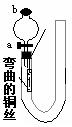 ⑴写出铜和稀硝酸反应的化学方程式____________________。
⑴写出铜和稀硝酸反应的化学方程式____________________。
⑵为测定铜和稀硝酸反应速率[υ(NO)],
本实验需要记录的实验数据为: _______ __、
______ __
⑶实验前怎样检验装置的气密性:
 _________________
______。
_________________
______。
⑷为保证实验的成功,加入一定量稀硝酸是很重要的操
作,你认为应怎样进行为好?__________________
后将弯曲的铜丝迅速伸入溶液并开始____ __。
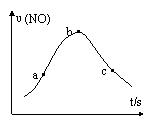
⑸该兴趣小组同学对实验数据进行处理后得到用NO表示铜和稀硝酸的反应速率和时间的关系图如右图所示。则:
① a→b,υ(NO)变化的主要原因是
b→c,υ(NO)变化的主要原因是 。
四、计算题(本题包括3小题,共15分)
25.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
26、(7分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[ 入料V(N2)∶V(H2)=1∶3]
|
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200℃ | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300℃ | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400℃ | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500℃ | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600℃ | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向 方向移动,正反应方向为 反应。
(2)根据平衡移动原理,合成氨适宜的条件是 。
A 高温高压 B 高温低压 C 低温高压 D 低温低压
(3)计算500℃,30MPa时N2的转化率 。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。
27.(5分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
![]() 2SO2
+ O2 2SO3 测得平衡时容器中压强是起始时压强的5/6倍,求:
2SO2
+ O2 2SO3 测得平衡时容器中压强是起始时压强的5/6倍,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
 NH3 压强/MPa
NH3 压强/MPa