高二年级化学第三次质量检测试题
化 学
时间:100分钟 总分:120分
可能用到的原子量:H:1 C:12 O:16 Na:23 N:14
一、单项选择题(本题包括8小题,每小题3分。共计24分。每小题只有一个选项符合题意)
1、下列物质中属于弱电解质的是
A.醋酸 B.氯气 C.蔗糖 D.碳酸钙
2、对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂
3、在100℃时,水的离子积为1×10-12,此时纯水中c(H+)=1×10-6,pH=6。则纯水在该温度下显
A.酸性 B.碱性 C.中性 D.无法确定
4、下列说法不正确的是
A.体系有序性越高,熵值就越低 B.知道了某过程有自发性之后可预测过程完成的快慢
 C.吸热反应不一定不能自发进行 D.同种物质气态时熵值最大
C.吸热反应不一定不能自发进行 D.同种物质气态时熵值最大
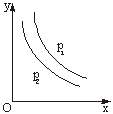
5、反应:L(s)+aG(g)![]() bR(g)达到平衡,温度和压强对该反应的
bR(g)达到平衡,温度和压强对该反应的
影响如右图所示,图中:压强p1>p2,x轴表示温度,y轴表示平
衡混合气体中G的体积分数。据此可判断
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. 无法确定a、b的大小
6、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ② K+、Mg2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
7、可用右侧示意图象表示的是
|
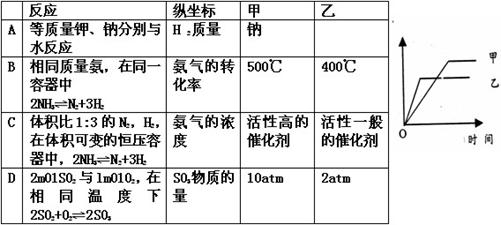
| |||||||||||
| |||||||||||
|
| ||||||||||
| |||||||||||
8、在298K、1.01×105pa下,12 g石墨在24 g氧气中燃烧至反应物完全消耗,测的放出XkJ(x>0)的热量。已知在该条件下,1 mol 石墨完全燃烧放出ykJ(y>0)的热量。则石墨与氧气反应生成CO的热化学方程式表达正确的是
A、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)= — ykJ. mol-
O2(g)=CO(g) △H(298K)= — ykJ. mol-
|
|
|
C、C(石墨,s)+![]() O2(g)=CO(g) △H(298K)= —(2x-y)kJ. mol-
O2(g)=CO(g) △H(298K)= —(2x-y)kJ. mol-
D、2C(石墨,s)+O2(g)=2CO(g) △H(298K)= —(2x-y)kJ. mol-
 二、不定项选择题:(本题包括8小题.每小题3分。共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。)
二、不定项选择题:(本题包括8小题.每小题3分。共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。)
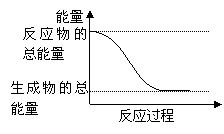
9、下列变化为放热的化学反应的是
A、H2O(g)=H2O(l) △H=-44.0 kJ/mol
B、2HI(g)=H2(g)+I2(g) △H = +14.9kJ/mol
C、形成化学键时共放出能量862 kJ的化学反应
D、能量变化如图所示的化学反应
10、灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq) + H2(g) △H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H2
![]()
![]()
![]()
![]()
|
下列说法正确的是
A. △H1 >△H2
B. 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
C. 锡在常温下以灰锡状态存在
D. 灰锡转化为白锡的反应是放热反应
11、一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)(正反应为放热反应)。现利用此反应,拟设计一种环保装置以减轻汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是
N2(g)+2CO2(g)(正反应为放热反应)。现利用此反应,拟设计一种环保装置以减轻汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是
A.选用适当催化剂 B.提高反应装置的温度
C.降低反应装置的压强 D. 在反应装置中装入碱石灰
12、将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是
A、升高温度,X的体积分数增大
B、增大压强,Z的浓度不变
C、保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D、保持容器体积不变,充入一定量的Z,X的体积分数增大
13、下列关于盐酸与醋酸两种稀溶液的说法正确的是
A、相同浓度的两溶液中c(H+)相同
B、pH=3的两溶液稀释100倍,pH都为5
C、相同浓度时导电能力醋酸强
D.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
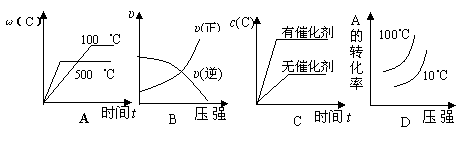
![]() 14、对于可逆反应:2A(g)+B(g) 2C(g)
△H<0,下列各图中正确的是
14、对于可逆反应:2A(g)+B(g) 2C(g)
△H<0,下列各图中正确的是
15、在一定温度下发生反应:![]()
![]()
![]() ;
;![]() 并达平衡。HI的体积分数
并达平衡。HI的体积分数![]() 随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下![]() 的变化如曲线(I)所示。在乙条件下
的变化如曲线(I)所示。在乙条件下![]() 的变化如曲线(III)所示。则甲条件、乙条件分别是 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度③ 恒温条件下,缩小反应容器体积④
恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂
的变化如曲线(III)所示。则甲条件、乙条件分别是 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度③ 恒温条件下,缩小反应容器体积④
恒温条件下,扩大反应容器体积⑤ 恒温恒容条件下,加入适当的催化剂
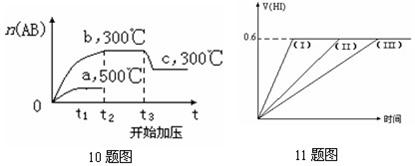
A. ①⑤,③ B. ②⑤,④ C. ③⑤,② D. ③⑤,④
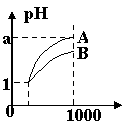 16、pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
16、pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.若1< a < 4,则A、B都是弱酸。
三、(本题包括2小题,共17分)
17、(6分)请设计两种不同的实验方案,鉴别物质的量浓度分别为0.05mol·L-1和0.005mol·L-1的两种稀H2SO4,可供选择的试剂有:①紫色石蕊试液 ②酚酞试液 ③甲基橙试液 ④蒸馏水 ⑤BaCl2溶液 ⑥pH试纸(标准比色卡) ⑦0.1mol·L-1 Na2S2O3溶液。简述操作过程。
(提示:Na2S2O3+ H2SO4= Na2 SO4+ SO2↑+ S↓+ H2O)
方案1:
方案2:
18、( 11分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250ml溶液,需要的主要仪器有 。
(2)滴定
① 用 量取10.00ml待测液。
② 用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,加入几滴酚酞,边滴边摇动锥形瓶,眼睛注视 ,直到 时停止滴定
(3)数据处理
| 实验次数编号 | 盐酸溶液体积 V(ml) | 氢氧化钠溶液体积 V(ml) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 ,烧碱的纯度为 。
(4)下列操作,会导致实验结果偏低是 (填序号)。
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来
四、(本题包括2小题,共17分)
19、(8分)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的KW=_________ 。在此温度下,将pH=a的NaOH溶液V(a)L与pH=b的H2SO4 溶液V(b)L混合(不考虑混和后体积变化)。
(1)若所得混合液为中性,且a=12,b=2,则V(a):V(b)= ___________;
(2)若所得混合液为中性,且a+b=12,则V(a):V(b)= ____________;
(3)若所得混合液的pH=10,且a=12,b=2,则V(a):V(b)= _________。
20、(9分)(1)火箭推进器中盛有强还原性液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即生成大量氮气和水蒸气,并放出大量的热,已知0.4moL液态肼与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65KJ的热量:
① 该反应的热化学方程式为
② 已知:H2O(g)→H2O(L) ;△H= —44KJ/moL,则16g液态肼与液态双氧水反应生成液态水时放出的热量是
③ 此反应应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
①途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是______ _________。
五、(本题包括4小题,共28分)
21、(8分)在一定体积的密闭容器中,进行如下化学反应:
|
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应为 反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(5)若830℃时,向容器中充入1 molCO、5 molH2O,反应达到平衡后,CO的转化率为
22、(6分)有两个密闭容器A和B,A保持恒压(即有一个能移动的活塞),B保持恒容。起始时向这两容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,且A和B的容积相等,在400℃时发生反应:2SO2(g)+O2(g)
![]() 2SO3(g)
2SO3(g)
(1)达到平衡所需时间A___________________B(填“大于”或“小于”,下同),SO2的转化率A______________B。
(2)达到(1)所述的平衡后。若向两容器中通入少量且等量的氩气,则A中化学平衡向______________(填正反应、逆反应)方向移动,B中化学平衡_________(填向正反应方向移动、向逆反应方向移动或不移动)。
(3)达到(1)所述的平衡后。若向两容器中通入等量的原反应气体.达到平衡时,SO3的百分含量,A中_________B中_________(填增大、减小或不变)。
23、(6分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:
![]() 2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
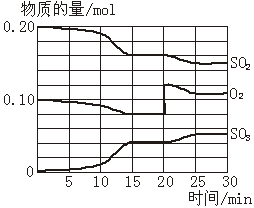 |
(1)反应处于平衡状态的时间段是____ ___。
(2)反应进行至20 min时,曲线发生变化的原因是________ ______________(用文字表达)
(3)10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积 c. 降低温度 d. 增加SO3的物质的量
24、(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
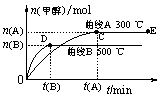
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。(填表达式)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
六、(本题包括1小题,共10分)
![]() 25、(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
25、(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述方程式:
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”) ;
(5)若已知CO生成速率为v(CO)=18mol/(L.min), 则N2消耗速速率为
v(N2)= mol/(L.min)。