高二年级化学第二学期3月月考试卷
化学科
考试时间: 90分钟 满分100 分 考试范围:高二1~5章
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,Mg—24,Al—27,S—32,
一、选择题(每小题只有一个正确选项,每小题3分,共51分,答案填入表格中)
1.随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
2.在冶金工业上,通常不能用化学还原剂制得的金属是
①Na ②Mg ③Al ④Fe ⑤Cr
A.②③ B.④⑤ C.①②③ D.①②③④⑤
3、2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物。下列关于碳氢化合物的叙述正确的是
A 碳氢化合物的通式为CnH2n+2 B 石油的主要成分是碳氢化合物
C 乙炔是含碳量最高的碳氢化合物 D 碳氢化合物中的化学键都是极性键
4.下列有机物命名正确的是
A.2,4,4-三甲基戊烷 B.2-乙基丁烷
C.2,2,3,4-四甲基戊烷 D.3,4,4-三甲基戊烷
5.主链含5个碳原子,有甲基、乙基2个支链的烷烃有:
A. 1种 B.2种 C. 3种 D. 4种
6.科学家发现的C60是一种新的分子,它是空心的具有类似足球的结构,被称为“分子足球”;
最近日本科学家确认世界上还存在一种“分子足球N60”,它与C60的结构相似,而且在高
温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60下列说法中正确的
是 ( )
A.N60是化合物,不是单质
B.N60与14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界的新天地,将来会成为较好的火箭燃料
7..组成为C4H9Cl的卤代烃,可能存在的同分异构体有
A.三种 B.四种 C.五种 D.六种
8、下列说法正确的是
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4 > C2H4 >C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,
只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,
完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,
则该有机物的类型肯定为烷烃
A ①②③ B ①②③④ C ②③ D 以上组合均不正确
9.反应
2A(g)
+ B(g)![]() 2C(g)(正反应是吸热反应)。下列反应条件有利于
2C(g)(正反应是吸热反应)。下列反应条件有利于
生成C的是
A. 低温、低压 B. 低温、高压
C. 高温、高压 D. 高温、低压
10.向一定量的下列物质的溶液中逐滴加入稀盐酸溶液,先生成白色沉淀,后沉淀逐渐溶解,
这种物质是
A.AgNO3 B.NaAlO2 C.A1C13 D.MgSO4
11..25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.C (NH4+) = C (SO42-) B.C (NH4+) > C (SO42-)
C.C (NH4+) < C (SO42-) D.C (OH—) + C (SO42-) = C (H+) + C (NH4+)
12.铜粉放人稀H2SO4中加热后无明显现象,当加入一种盐后铜粉质量减小溶液变蓝,
同时有气体逸出,此盐可能是
A.FeSO4 B.Na2CO3 C.KNO3 D.KCl
13.用已知浓度的盐酸滴定未知浓度NaOH溶液。某学生有如下操作:
① 酸式滴定管用蒸馏水洗后未用标准液润洗,
②读取标准液体积时,滴定前仰视,滴定后俯视。
③ 滴定前酸式滴定管尖嘴处未充满溶液,
④ 取待测碱液时,碱式滴定管尖嘴未充满溶液,
⑤ 锥形瓶用蒸馏水洗后用待测碱液润洗,
以上操作中会导致待测碱液浓度测定值偏低的是
A.①③⑤ B.①②③④ C.②④ D.②⑤
14.在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:
![]() CH3COOH CH3COO-+H+
对于该平衡,下列叙述正确的是:
CH3COOH CH3COO-+H+
对于该平衡,下列叙述正确的是:
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
![]()
 15、下列反应的离子方程式书写不正确的是
15、下列反应的离子方程式书写不正确的是
A.氯化铝溶液中加入足量的氨水: Al3++3OH—= Al(OH)3↓
B. 铜跟浓硝酸反应:Cu+2NO3—+4H+=Cu2++2NO2↑+2H2O
C.铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+
D.氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl—
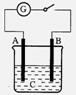 16.如图所示,把A、B插入C的溶液中,闭合电键K后电流仪G的指针会发生 偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质
16.如图所示,把A、B插入C的溶液中,闭合电键K后电流仪G的指针会发生 偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质
A.A—Cu B—Zn C—CuSO4
B.A—Ag B—Fe C—HCl
C.A—Zn B—石墨 C—H2SO4
D.A—石墨 B—Zn C—H2SO4
17.将5.1g镁、铝合金投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多,则应加入的NaOH溶液体积为
A.200 mL B.250 mL C.425 mL D.560 mL
选择题答题表:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18.(14分)现有有机物:①甲烷 ②乙烯 ③乙炔 ④氯乙烯 ⑤聚乙烯⑥苯 ⑦间二甲苯
按下列要求填空:
(1)它们中属于同系物的是 (填序号)
(2)常温下能与溴水发生加成反应的是 (填序号);
(3)鉴别⑥⑦所用试剂是 ;
(4)写出实验室制取③的化学方程式:
(5)写出用④制取常见塑料的化学方程式:
该反应类型属于
(6)写出用⑥与浓硫酸及浓硝酸在50-60℃时反应的化学方程式
该反应类型属于 。
19.(4分)钢铁在潮湿的空气中发生电化学腐蚀,请写出电极反应式,正极为: ;负极为: 。
20.(6分)(1)配置FeSO4溶液时,常加入一些 ,
目的是 。
(2)如何检验某FeSO4溶液已经变质?
。
21.(8分)白色固体Y既可溶于盐酸,又可溶于NaOH溶液。根据以下化学反应框图填空:(部分反应产物己略去)
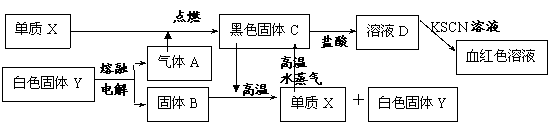
(1)写出下列物质的化学式:X__________________,Y________________;
(2)写出Y溶于NaOH溶液的离子方程式: _________________________________________;
(3)写出B和C反应的化学方程式: _______________________________________________;
(4)写出X与水蒸气反应的化学方程式: _____________________________________________;
22(12分)有某种含有少量氯化亚铁杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采取以下步骤进行:
①准确称量m g样品(在2~3 g范围内)。
②向样品中加入10 mL 6 mol·L-1盐酸,再加入蒸馏水,配制250 mL溶液。
③量取25 mL操作②中配得的溶液,加入3 mL溴水,加热使反应完全。
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全。
⑤过滤,将沉淀洗涤、灼烧、冷却、称量,反复操作至恒量。
根据以上叙述,回答:
(1)在称量样品时,若称量前天平的指针偏向标尺左方,称量读数时,指针刚好在标尺中央,所得样品质量是____________(填编号)。A.比m g多 B.比m g少 C.恰好m g
(2)溶解样品时要加入盐酸,原因是______________________________________________。
(3)加入溴水后,发生反应的离子方程式为________________________________________。
(4)加入氨水要过量的原因是______________________________________________________。
(5)检验沉淀是否洗涤干净的方法是_________________________________________________。
(6)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量为W2 g,则样品中铁元素的质量分数是
______________________________。
23.(5分)某烃含碳的质量分数为90.6%,其蒸气密度为相同条件下H2密度的53倍。
该烃能使酸性KMnO4溶液褪色,不能使溴水因化学反应而褪色,则其分子式为 ;
若该烃硝化时,一硝基取代物只有二种,则该烃的结构简式为 。