高二年级化学能力测试题[2]
[ ]1.决定化学反应速率的主要原因是
A.参加反应物质的性质 B.加入催化剂
C.温度和压强 D.各反应物和生成物的浓度
[ ]2.升高温度时,化学反应速率加快,主要原因是
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
[ ]3.反应C(s)+H2O(g)![]() CO(g)+
H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+
H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量 B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大 D.保持压强不变,充入N2使容器体积变大
[ ]4.在一密闭容器中充入一定量的N2和H2,经测定反应开始后3秒末,H2的速率为0.3mol/L·S则3秒末NH3的浓度为
A.0.45mol/L B.0.5mol/L C.0.6mol/L D.0.55mol/L
[
]5.在某温度下,可逆反应mA + nB![]() pC + qD的平衡常数为K,下列说法正确的是
pC + qD的平衡常数为K,下列说法正确的是
A.K越大,达到平衡时,反应进行的程度越大 B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变 D.K随温度和压强的改变而改变
[
]6.对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为![]() ,(x代表某反应物或生成物)之间的关系,正确的是
,(x代表某反应物或生成物)之间的关系,正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
[ ]7.在下列平衡2CrO42-(黄色)+2H+![]() Cr2O72—(橙红色)+H2O中,溶液颜色介于黄和橙红色之间今欲使溶液的橙红色加深,则要在溶液中加入
Cr2O72—(橙红色)+H2O中,溶液颜色介于黄和橙红色之间今欲使溶液的橙红色加深,则要在溶液中加入
A.H+ B.OH- C.K+ D.H2O
[ ]8.一定条件下向一带活塞的密闭容器中充入2molSO2和1molO2,发生如下反应:
2SO2(g) +O2(g)![]() 2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
A.保持温度和容器的体积不变,充入1molSO2(g) B.保持温度和容器内压强不变,充入1molAr(g)
C.保持温度和容器内压强不变,充入1molO2(g) D.保持温度和容器内压强不变,充入1molSO3(g)
[ ]9.在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时测得CO2为
0.6mol,再通入4mol水蒸气,达到平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为
0.6mol,再通入4mol水蒸气,达到平衡后,CO2的物质的量为
A.0.6mol B.1mol C.大于0.6mol D.大于1mol
[ ]10.在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是
3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
[ ]11.在密闭容器内放入5molSO2和5molO2,在某温度下经过反应生成2molSO3,此时密闭容器内压强是反应前压强的倍数为
A.2倍 B.1.5倍 C.0.9倍 D.0.5倍
[
]12.对己达化学平衡的下列反应: 2X(g) +Y(g)![]() 2Z(g)
,减小压强时,对反应产生的影响
2Z(g)
,减小压强时,对反应产生的影响
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率减小,平衡向逆反应方向移动
D. 正、逆反应速率减小,平衡向正反应方向移动
[
]13.在一定条件下反应x A + y B![]() z C达到平衡。下列说法中正确的是
z C达到平衡。下列说法中正确的是
A.若C是气体,且x + y = z ,则增大压强平衡一定不移动
B.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x + y < z
C.若B、C都是气体,其它条件不变,增大A的物质的量平衡不移动,则A为固态或液态
D.若升高温度C的质量分数减少,则正反应是吸热反应
[ ]14.在一个恒温密闭容器中,放入3L气体X和2L气体Y,在一定条件下发生下列反应:
4X(g)+3Y(g)![]() 2Q(g)+nR(g)。达到平衡时,容器内压强比原来增加5%,X的浓度减少
1/3则该反应式中的n应为
2Q(g)+nR(g)。达到平衡时,容器内压强比原来增加5%,X的浓度减少
1/3则该反应式中的n应为
A.3 B.4 C.5 D.6
[ ]15.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是
A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2 D.单位时间消耗0.1mol X同时消耗0.2mol Y
[ ]16.在一定温度和压强下,N2+3H2![]() 2NH3达到平衡,下列说法使平衡不发生移动的是
2NH3达到平衡,下列说法使平衡不发生移动的是
A.恒温恒压时充入氨气 B.恒温恒容时充入氮气
C.恒温恒容时充入氦气 D.恒温恒压时充入氦气
[ ]17. 在两个恒容容器中,有平衡体系:A(g)![]() 2B(g)
和2A(g)
2B(g)
和2A(g)![]() B(g),X1和X2分别是A的转化率。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g),X1和X2分别是A的转化率。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. X1降低 X2增大 B. X1、X2均降低 C. X1增大,X2降低 D. X1、X2均增大
[ ]18. 在2A+B![]() 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
[
]19. 在一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g)进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%。则反应开始时,充入容器中的X和Y的物质的量之比为
2Z(g)进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%。则反应开始时,充入容器中的X和Y的物质的量之比为
A.1:3 B.3:1 C.1:2 D.2:1
[ ]20. 一定条件下,可逆反应N2 +3H2![]() 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A. 加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B. 加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C. 降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D. 增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数
[ ]21. 在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.物质A的转化率小了 B.平衡向正反应方向移动了 C.物质B的质量分数减小了 D.a>b
 [ ]22. 一定温度下,在带活塞的密闭容器中,反应H2(g) +I2(g)
[ ]22. 一定温度下,在带活塞的密闭容器中,反应H2(g) +I2(g)![]() 2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
A.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
B.恒温时,减小容积平衡不移动,但气体颜色加深
C.恒容时,通入H2,I2的质量分数减小
D.恒压时,通入HI气体,刚开始时正反应速率会减小
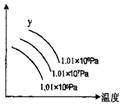
[
]23. 右图表示外界温度和压强对反应L(s)+G(g)![]() 2R(g)(正反应
2R(g)(正反应
是吸热)的影响,图中y的意义为
A.平衡混合气中R的体积分数 B.平衡混合气中G的体积分数 C.L的转化率 D.R的产率
[ ]24.已知反应:PC15(g)![]() PC13
(g)+ C12(g)将1.0
mol PC15充入容积为2 L的密闭容器中.一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4
mol/(L·min),则这段时间为
PC13
(g)+ C12(g)将1.0
mol PC15充入容积为2 L的密闭容器中.一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4
mol/(L·min),则这段时间为
A. 50 s B. 30 s C. 5 s D. 1 s
[ ]25.右图中a曲线表示一定条件下的可逆反应 X (g) + Y (g)![]() 2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
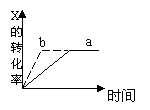 A.增大压强 B.增大X的浓度C.升高温度 D.加入W
A.增大压强 B.增大X的浓度C.升高温度 D.加入W
[ ]26.对于一个密闭容器中进行的可逆反应:mA(气) + nB(气)![]() eC(气 )+dD (气)
ΔH<0,下列能证明该反应一定达到平衡状态的是
eC(气 )+dD (气)
ΔH<0,下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每消耗m个A分子的同时也生成了d个D分子
C.单位时间内每生成e个C分子的同时也生成了n个B分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
[ ]27.某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应∶
A(g)+2B(g)![]() 2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是
2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是
A.原混合气体的体积为1.5V B.原混合气体的体积为1.25V
C.反应达到平衡时,气体A消耗了0.5V D.反应达到平衡时,气体B消耗了0.25V
[ ]28.在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2(g) 、Y2(g)、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2(g) 、Y2(g)、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.X2为0.2mol/L
B.Y2为0.35mol/L C.Z为0mol/L D.![]() 为0.4mol/L
为0.4mol/L
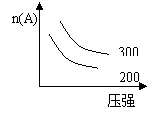 [ ]29.如图所示,不能适用于下列可逆反应的是
[ ]29.如图所示,不能适用于下列可逆反应的是
A 3A(g)+B(g) ![]() 2C(g);ΔH<0 B. A(g)+ 3B(s)+2C(g)
2C(g);ΔH<0 B. A(g)+ 3B(s)+2C(g) ![]() 3D(g)ΔH<0
3D(g)ΔH<0
C. C(s)+D(g) ![]() A(g)+ B(g)ΔH>0 D. 2C(g)
A(g)+ B(g)ΔH>0 D. 2C(g) ![]() 2A(g)+B(g) ΔH>0
2A(g)+B(g) ΔH>0
30.右图是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[υ(NO)]的实验装置图。试回答下列问题:
 ⑴写出铜和稀硝酸反应的化学方程式_____________________________
。
⑴写出铜和稀硝酸反应的化学方程式_____________________________
。
⑵为测定铜和稀硝酸反应速率[υ(NO)],本实验需要记录的实验数据为:________ 、________
⑶实验前怎样检验装置的气密性 。
__________________________________
。
⑷为保证实验的成功,加入一定量稀硝酸是很重要的操作,你认为应怎样进行为好?
_________________________________后将弯曲的铜丝迅速伸入溶液并开始______________ 。
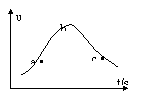 ⑸该兴趣小组同学对实验数据进行处理后得到用NO表示铜和稀硝酸的反应速率和时间的关系图如下图所示。则:
⑸该兴趣小组同学对实验数据进行处理后得到用NO表示铜和稀硝酸的反应速率和时间的关系图如下图所示。则:
①a→b.υ(NO)变化的主要原因是________________________
②b→c.υ(NO)变化的主要原因是_________________________ 。
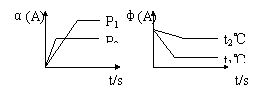 31.可逆反应∶aA(g)
+ bB(g)
31.可逆反应∶aA(g)
+ bB(g)![]() cC(g)
+ dD(g) ; △H,试根据图回答∶
cC(g)
+ dD(g) ; △H,试根据图回答∶
[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
⑴压强P1比P2_________(填大、小)
⑵体积(a+b)比(c+d)________(填大、小)
⑶温度t1℃比t2℃_______(填高、低)
![]() ⑷ H值是________(填正、负)
⑷ H值是________(填正、负)
32.等物质的量的A、B、C、D四种物质混合,发生如下反应∶aA + bB![]() cC(s)
+ dD。当反应进行一段时间后,测得A减少了n
mol,B减少了n
/ 2 mol,C增加下3
/2 n mol,D增加了n
mol,此时达到化学平衡∶
cC(s)
+ dD。当反应进行一段时间后,测得A减少了n
mol,B减少了n
/ 2 mol,C增加下3
/2 n mol,D增加了n
mol,此时达到化学平衡∶
(1)该化学方程式的各系数为a=______ ;b=_____ ;c=_____ ;d=______ 。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态
A__________ ;B_________ ;D__________ 。
 ⑶若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为_________ 反应(填放热或吸热)。
⑶若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为_________ 反应(填放热或吸热)。
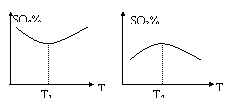
33.在工业上制硫酸中,有如下可逆反应:
2SO2(g)+
O2(g)![]() 2SO3(g),其中SO2(g)和SO3(g)的体积分数随温度变化的曲线如图所示:试回答下列问题:
2SO3(g),其中SO2(g)和SO3(g)的体积分数随温度变化的曲线如图所示:试回答下列问题:
(1)由曲线可知,此反应的正反应为 热反应(填“放” 或“吸”)。T1 ________T2(填“>”、“<”或“=”)
(2)这两种曲线变化形状相反的原因是
![]() 34.对于反应2L(g)+3M(g)
XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请回答:
34.对于反应2L(g)+3M(g)
XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请回答:
(1)
x的值是
(2) L的转化率是
(3) M的反应速率![]() 是
是
35.在恒温时,某容积为V L的密闭容器中通入2 moL X和1 moL Y气体,发生如下反应:2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)若与上述平衡保持同温、同压,另取4 moL X(气)和2 moL Y(气)达平衡,则Z的体积分数为
平衡时,气体的总体积为 ;
(2)若与上述平衡保持同温、同压,于一密闭容器中充入X(气)和Y(气)的物质的量分别记为a、b,平衡时Z的体积分数也恰好为0.4。若恒有m< ![]() < n,则
m = ,n = 。
< n,则
m = ,n = 。
参考答案
1A 2B 3C 4C 5A 6D 7A 8D 9C 10D 11C 12C 13C 14D 15B 16C 17A 18B 19C 20C 21B 22A 23B 24B 25A 26C 27B 28B 29B
30.⑴3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑ + 4H2O
⑵NO的体积、反应时间
⑶关闭分液漏斗盖b和活塞a,从U管长管处置水至U管长管中液面高于短管中液面,过一会,若液面差保持不变,则装置气密性良好。
⑷打开分液漏斗盖b和活塞a,从U管右端注入稀HNO3至排尽U管左端空气,关闭活塞a; 记录时间;
⑸①铜和稀硝酸反应是放热反应,体系温度升高,反应速率加快。 ②反应进行一段时间后,体系与环境的温差大,散热加快,体系温度变化不大甚至有所下降,c(HNO3)降低,反应速率降低。
31.(1) 小 (2) 小 (3) 高 (4) 正
32.(1) 2;1;3;2 (2) 气,固或液;气 (3) 放热。
33.(1) 放 =
(2) 在未达平衡前,温度升高,v(正) 、v(逆) 均增大,但正反应速率增大的倍数大于逆反应速率增大的倍数,所以SO2%减小,SO3%增大;达平衡后,由于正反应为放热反应,升高温度,平衡向逆反应方向移动,故SO2%增大,SO3%减小。
34.⑴1 ⑵80% ⑶0.6molL-1min_1
![]() 2L(g)+3M(g)
XQ(g)+3R(g)
2L(g)+3M(g)
XQ(g)+3R(g)
n始 2 3 0 0
n转 1.6 2.4 0.8 2.4
n平 0.4 0.6 0.8 2.4
35.⑴ 0.4 5mol ;
⑵ m= 0.5 n= 5