高二化学《镁和铝》单元检测试题
姓名
(全卷满分:100分 考试时间:60分钟)
可能用到的相对原子质量:H—1 N—14 O—16 Mg—24 Al—27 Fe—56 Zn—65 Ag—108
一、选择题(本题共15个小题,每小题3分,共45分。每小题均有1 ~ 2个选项符合题意)
1.工业上制取镁粉是将镁的蒸气进行冷却,冷却的最好方法是( )
A.在N2中冷却 B.在H2中冷却 C.在水中冷却 D.在CO2中冷却
2.下列离子反应方程式正确的是( )
A.铝溶解在NaOH溶液中:2Al + 2OH― + 2H2O
== 2AlO![]() + 3H2↑
+ 3H2↑
B.氨水滴入AlCl3溶液中:Al3+ + 3OH― == Al(OH)3↓
C.MgO溶于稀HCl中:O![]() + 2H+ == H2O
+ 2H+ == H2O
D.Al(OH)3溶于稀H2SO4中:OH― + H+ == H2O
3.某无色透明溶液,能与铝作用放出氢气,此溶液中可以大量共存的离子组是( )
A.H+、Mg2+、Cl―、Ba2+
B.SO![]() 、Na+、HCO
、Na+、HCO![]() 、K+
、K+
C.Cu2+、OH―、SO![]() 、Fe2+
D.NO
、Fe2+
D.NO![]() 、OH―、Cl―、Ba2+
、OH―、Cl―、Ba2+
4.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加足量盐酸,如果放出等体积的氢气(同温同压),两份铝粉的质量之比为( )
A.1∶2 B.1∶3 C.3∶2 D.1∶1
5.1mol金属镁在空气中燃烧,所得固体的质量是( )
A.40g B.略大于40g C.略小于40g D.无法判断
6.已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气
7.锌粉、铝粉的混合物44g与一定量浓度为17.25%的硫酸溶液恰好反应,将溶液蒸发结晶得干燥的无水固体140g,则放出的气体在标准状况下的体积为( )
A.无法计算 B.6.72L C.33.6L D.22.4L
8.将100mL3mol·L―1的NaOH溶液与100mL1mol·L―1AlCl3溶液按下列两种方法混合:
(1)将NaOH溶液分多次加到AlCl3溶液中(边加边搅拌)
(2)将AlCl3溶液分多次加到NaOH溶液中(边加边搅拌)
上述两种实验所得正确的结论为( )
A.现象相同,沉淀量相等 B.现象相同,沉淀量不等
C.现象不相同,沉淀量相等 D.现象不同,沉淀量不同
9.两种金属混合粉末15g,与足量的盐酸反应时,生成11.2LH2(标况),符合上述情况的金属混合物是( )
A.Mg和Ag B.Mg和Al C.Al和Zn D.Fe和Zn
10.下列实验中,先产生白色沉淀后沉淀又溶解的是( )
A.NaOH溶液中滴入AlCl3溶液至过量
B.AlCl3溶液中滴入NaOH溶液至过量
C.NaAlO2溶液中滴入盐酸至过量
D.盐酸中滴入NaAlO2溶液至过量
11.在K2SO4和Al2(SO4)3的混合溶液中,已知Al3+的浓度为0.2mol/L,SO![]() 的浓度为0.4mol/L,则该溶液中的K+浓度为( )
的浓度为0.4mol/L,则该溶液中的K+浓度为( )
A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L
12.将100mL2mol/lAlCl3溶液跟一定体积的4mol/lNaOH溶液混合后可得7.8g沉淀。则NaOH溶液的体积可能是( )
A.75mL B.150mL C.175mL D.200mL
13.将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.125mL B.200mL C.250mL D.560mL
14.下列各对物质中不能产生氢气的是( )
A.Zn + HCl B.Al + HNO3(浓 常温) C.Al + NaOH溶液 D.Mg + H2O(沸腾)
15.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
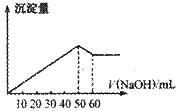 A.6∶1
B.3∶1
A.6∶1
B.3∶1
C.2∶1 D.1∶2
二、填空题(本大题包括3小题,共38分)
16.(15分)写出下列反应的化学方程式
(1)Mg在CO2中燃烧
(2)Al与NaOH溶液反应
(3)Al粉和MnO2的混合物在高温条件下反应
(4)Al2(SO4)3溶液中加入过量氨水
(5)NaAlO2溶液中滴加少量稀HCl
17.(15分)写出下列反应的离子方程式
(1)Al与稀H2SO4反应
(2)Al与NaOH溶液反应
(3)Al(OH)3沉淀溶于NaOH溶液
(4)Al2O3与NaOH溶液反应
(5)NaAlO2溶液中通入CO2气体
18.(8分)某无色透明溶液,加入金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、SO![]() 、HCO
、HCO![]() 、OH―、NO
、OH―、NO![]() 在下列两种情况中,可能存在于此溶液中的是:
在下列两种情况中,可能存在于此溶液中的是:
①当与Al反应后,生成Al3+时,原溶液中可能存在的离子有 。
②当与Al反应后,生成AlO![]() 时,原溶液中可能存在的离子有
。
时,原溶液中可能存在的离子有
。
三、实验题(本大题共17分)
19.(17分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
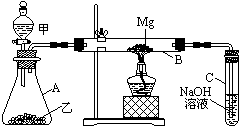 Ⅰ.用如图所示装置进行Mg和SO2的实验。
Ⅰ.用如图所示装置进行Mg和SO2的实验。
(1)选择制取SO2的合适试剂 。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:
。
装置C中NaOH溶液的作用是 。
(3)你认为该装置是否有不足之处? 。如果有,请一一说明
。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是 。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是
。
高二化学《镁和铝》单元检测试题参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | A | AD | D | C | AC | D | C | AC | BC | B | AC | C | B | D |
16.略
17.略
18.(1)H+、SO![]() 、Mg2+
、Mg2+
|
|
|
|
(4)2Mg + SiO2 == 2MgO + Si(2分)
|