高二年级化学上册期中考试
考试时间:90分钟 满分:100分
相对分子质量:H—1; O—16;Al—23;S—32;Ba—137
一、选择题(单选题,每题2分,共48分)
⒈下列物质中,属于纯净物的是 ( )
A. 碱石灰 B.铝热剂 C.赤铁矿 D.冰晶石
2.高炉炼铁时,加入石灰石的主要作用是 ( ) A.除去硫和磷 B.形成合金 C.除去碳 D.做为助熔剂
3.下列物质中属于电解质,但在给定条件下不能导电的是 ( )
A.稀硫酸 B.液态溴化氢 C.铝 D.蔗糖
4.下列叙述中,能证明某物质是弱电解质的是 ( )
A.熔化时不导电 B.不是离子化合物,而是极性共价化合物
C.水溶液的导电能力很差 D.溶液中已电离的离子和未电离的分子共存
![]() 5.在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
5.在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
度增大,应采取的措施是 ( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
6. 把镁粉中混有的少量铝粉除去,应选用的试剂是 ( )
A.盐酸 B.氨水 C.烧碱溶液 D.纯碱溶液
7.1 mol 下列物质,在水中能电离出3 mol 离子的是 ( )
A.H2S B.Fe2(SO4)3 C.Ba(OH)2 D.NaCl
8.下列各式中,属于正确的电离方程式的是 ( )
A.HCO3- + H2O ![]() H2CO3 + OH-
B.HCO3- +OH- ==== H2O
+ CO32-
H2CO3 + OH-
B.HCO3- +OH- ==== H2O
+ CO32-
C.NH3 + H+
=== NH4+ D.NH3·H2O ![]() NH4+ + OH-
NH4+ + OH-
9.铁制容器能盛放浓硝酸而不被腐蚀得原因是 ( ).
A.浓硝酸具有强酸性 B.浓硝酸具有强氧化性
C.铁不能跟酸反应 D.铁具有较强的金属性
10.25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 ( ).
A.1×10-7mol·L-1 B.1×10-12mol·L-1.
C.1×10-2mol·L-1 D.1×10-14mol·L-1.
11.下列溶液肯定是酸性的是 ( )
A 含H+的溶液 B 加酚酞显无色的溶液
C pH<7的溶液 D C(OH-)<C(H+)的溶液
12.两份铝屑,第一份与盐酸反应,第二份与氢氧化钠反应,在相同状况下产生H2的体积比为1:2,则这两份铝的质量比是 ( )
A.1:1 B.1:2 C.1:3 D.2:1
13.下列说法中正确的是 ( )
A.钢铁因含杂质而容易发生电化腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化腐蚀的两种类型其主要区别在于水膜的pH不同引起的负极反应不同
D.无论哪种类型的金属腐蚀,其实质都是金属被氧化
14.下列各组物质反应后,加入KSCN溶液一定显红色的是 ( )
A.Fe粉和HNO3 B.Fe3O4和HNO3
C.FeCl3溶液和Fe粉 D.FeCl3和AgNO3的混合溶液
15.将铜粉和铁粉的混合物放入一定量的稀硝酸中微热,反应完毕后发现铜有剩余,则
溶液中含有的金属离子是 ( )
A.Cu2+ Fe3+ B.Cu2+ Fe3+ Fe2+ C.Fe2+ Fe3+ D.Cu2+ Fe2+
![]()
![]() 16.用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
( )
16.用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
( )
A.
B.
C.[H+]和[OH-]的乘积 D.OH-的物质的量
17.下列各组离子在指定环境下能大量共存的是 ( )
A. pH=1的溶液中 Na+、 S2-、K+、 MnO4-
B. pH=7的溶液中.Fe3+、Cl-、SO42-、HCO3-
C. pH>7的溶液中 Na+、S2–、SO32-、K+
D. pH=0的溶液中Na+、、K+、Fe2+、ClO-
18. 等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )
A. HCO3-+OH-=H2O+CO32-
B. 2HCO3-+Ba(OH)2=BaCO3↓+2H2O+CO32-
C. HCO3-+Ba2++OH-=H2O+BaCO3↓
D .2HCO3-+Ba2++OH-=BaCO3↓+2H2O+CO32-
19. 为了配制NH4+的浓度与Cl—的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
(1)适量的![]() (2)适量的
(2)适量的![]() (3)适量的氨水 (4)适量的
(3)适量的氨水 (4)适量的![]()
A. (1)(2) B. (3) C. (3)(4) D. (4)
20. 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH如何变化 ( )
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
21.能使铁溶解,又不生成固体和气体的是 ( )
①稀H2SO4 ②稀HNO3 ③Fe2(SO4)3溶液 ④CuSO4溶液 ⑤浓H2SO4 ⑥氨水
A.②③ B.④⑤ C.①④⑥ D.③
22.将适量的铁粉放入氯化铁溶液中,完全反应后,溶液中的Fe3+离子和Fe2+离子浓度相等.则已反应的Fe3+离子和未反应的Fe3+离子的物质的量之比 ( )
A.2:3 B.3:2 C.1:2 D.1:1
23.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是 ( )
A.2mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
24.有一块铝铁合金,溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧,完全变成红色粉末,经称量红色粉末和合金的质量相等,则合金中铝的含量为 ( )
A.70% B.30% C.47.6% D.52.4%
二.填空题(共32分)
25.(6分)使直流电通过含少量酚酞的饱和食盐水,阳极会放出有__________并能使碘化钾淀粉溶液____________的___________.阴极放出的气体是_________.同时还可观察到阴极附近溶液___________,说明溶液里有碱性物质生成,这种新物质是____________
![]() 26.(10分)在FeCl3溶液中存在着平衡体系:Fe3++3H2O
Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
26.(10分)在FeCl3溶液中存在着平衡体系:Fe3++3H2O
Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
| 条件 | 平衡移动方向 | Fe3+的浓度 | n(H+) | c(H+) |
| 加少量盐酸 | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
27.(6分)现有铁、氯气、盐酸、氧气和氢氧化钠溶液五种物质,从中选择有关物质,设计简单合理的方法由铁制取氧化铁,试用有关化学方程式来表示:
_______________________________________________________________________________
28.(5分)铝片的表面有一层保护膜,成份是_______(填化学式),除去保护膜的铝片涂以
Hg(NO3)2溶液后,铝片上产生少量的___________,将此铝条放置空气中片刻后表面出现________________现象,此反应方程式为___________________________________________
29.(5分) 某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
三、实验题(本题10分)
30.用下面两种方法可以制得白色的Fe(OH)2沉淀
方法一.用不含Fe2+的FeSO4溶液与用不含O2的
 蒸馏水配制的NaOH溶液反应制备。
蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时
还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含
O2的NaOH溶液,插入FeSO4溶液液面下,再挤
出NaOH溶液。这样操作的理由是 。
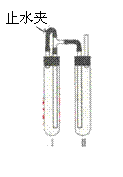
方法二.在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
。
四、计算题(本题10分)
31.(4分)现有铝铁合金粉末13.9g,投入500mL2mol/L的稀盐酸里充分反应后,剩余的盐酸用50mL6mol/L的NaOH溶液恰好中和,求铝、铁的百分组成。(计算结果保留一位小数)
32.(6分)今有稀盐酸和稀硫酸混合液100ml,当加入8.55g氢氧化钡粉末充分反应后过滤,干燥得沉淀4.66g,所得溶液PH=13(设反应后溶液体积仍为100mL)
(1)求原混合液中SO42-的物质的量浓度
(2)求原混合酸中Cl—的物质的量浓度
(3)在滤液中加入足量铝粉,写出反应的化学方程式,并计算在标准状况下产生的氢气多少升?
闸北新八中高二期中考试答题卷
一选择
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
二、填空
25______________ _____________ _____________ ____________
____________ ____________________
26
| 条件 | 平衡移动方向 | Fe3+的浓度 | n(H+) | c(H+) |
| 加少量盐酸 | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
27.
_____________________________________________________________________________-
28
____________________________ ________________________ ____________________
.29.
________ _________ __________ _________ ________
三、实验题
30.(1) _____________ (2) ______________________ (3) ________________________________
方法二(1)_____________ (2) ______________
(3) ___________________________________________________________________________
(4) ___________________________________________________________________________
四、计算题
31.
32.
答案
⒈D 2D 3B 4.D 5D 6 C 7C8B9B10B11D12B13D14D15D16B17C.18.C19.B20.C21D22A23A24B
26
| 条件 | 平衡移动方向 | Fe3+的浓度 | n(H+) | c(H+) |
| 加少量盐酸 | 向左 | 增大 | 增大 | 增大 |
| 加少量NaOH | 向右 | 减小 | 减小 | 减小 |
| 加少量Na2CO3 | 向右 | 减小 | 减小 | 减小 |
| 加水稀释 | 向右 | 减小 | 增大 | 减小 |
| 升高温度 | 向右 | 减小 | 增大 | 增大 |
30、(1)稀H2SO4铁屑 煮沸 (3)避免生成的Fe(OH)2沉淀接触O2
方法二(1)稀H2SO4铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹. (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入