出题说明:
电离平衡:25分
镁铝铁及金属冶炼:14
原电池及电解池:30
甲烷和烷烃:31
试题来源说明:除25题之外。其余均来源于书本课后和做过的习题原题,或变形
难度系数:2:7:1
高二年级化学上册第三次月考试题
化学 命题人:王 强
注意事项:
1.本试卷考试时间为90分钟,全卷满分为100分。
2.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,请将第Ⅰ卷选择题正确选项的标号(A、B、C、D)填写在答案栏内;请将第II卷答案直接填写在试卷中的空格上。
3. 可能用到的相对原子质量
H:1; C:12; O:16; Na:23; S:32; Cu:64;Ag:108
一、选择题,每题仅一项正确答案,每题2分,共计20分。
1、为了检验某FeCl2溶液是否变质,可向溶液试样中加入
A. NaOH溶液 B. 铁片
C. KSCN溶液 D.石蕊试液
2、下列各组金属最适合用H2或CO把它从化合物中还原出来的是
A. Cu、Na B. Al、Fe
C. Fe、Cu D.Mn、Ag
3、正在燃烧着的镁条,放入下列气体时,不能继续燃烧的是
A.CO2 B. Cl2 C. O2 D. Ne
4、下列方程式书写正确的是( )
A. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.H2SO3的电离方程式H2SO3![]() H++H SO3-
H++H SO3-
C. NaHSO4在水溶液中的电离方程式:NaHSO4=Na++ H SO4-
D.NaHCO3的电离方程式:NaHCO3=Na++H++CO3-
5、用0.01mol/L的NaOH溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是
A.盐酸 B.醋酸 C.高氯酸 D. 硫酸
6、向CH3COOH![]() CH3COO- + H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变小的是
CH3COO- + H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变小的是
A .H2O B. CH3COONa C. NH3·H2O D. H2SO4
7、有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A. Y>Z>W>X B. Z>Y>W>X
C. W>Z>Y>X D. X>Y>Z>W
8、下列各组物质中,互为同分异构体的是
A. O2和O3 B. 1 1H和2 1H
C. CH3CH(CH3) CH2CH3和 CH3CH2CH2CH2CH3
D. CH3CH2CH3和CH3CH2CH2CH3
9、相同物质的量的镁、铝、铁分别与足量的稀硫酸反应,生成相同状况下氢气的体积比为
A. 2:3:2 B. 1:1:2 C.1:2:2 D.3:4:2
10、CH3CH(C2H5)CH(CH3)2的名称是
A.2,3-二甲基戊烷 B.2-甲基-3-乙基丁烷
C.3,4-二甲基戊烷 D.1,3-二甲基戊烷
二、选择题,每题仅一项正确答案,每题3分,共计30分。
11、在标准状况时,甲烷和丙烷的混合气体的密度为1.027g/L, 则该气体中甲烷与丙烷的体积比
A. 3:1 B. 1:1 C. 1:2 D. 2:3
12、若要将0.6 mol甲烷完全和氯气发生取代反应,并且生成相同物质的量的四种取代物,则需氯气的物质的量为
A. 2.5 mol B. 4.5 mol C. 1.5 mol D. 0.6 mol
13、等质量的下列各烃完全燃烧时,消耗氧气由多至少的顺序是
①CH4、②C2H6、③C3H6、④C6H6
A. ③>②>①>④ B. ④>③>②>①
C. ①>②>③>④ D. ③>④>①>②
14、下列各溶液中,微粒物质的量浓度关系正确的是
A.0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)>c(CO32-)
B.0.1mol/L(NH4)2SO4溶液中:c(SO42-)> c(NH4+)> c(H+)> c(OH-)
C.0.1mol/L NaHCO3溶液中:c(Na+)> c(OH-)> c(HCO3-)> c(H+)
D.0.1mol/L Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
15、下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7;②用HF溶液做导电性实验,灯泡很暗;③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3;⑤HF能与Na2CO3溶液反应,产生CO2气体;⑥HF与水能以任意比混溶;⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①②⑦ B.②③⑤ C.③④⑥ D.①④
16、某一无色溶液,若向其中加入铝粉,有氢气放出,则该溶液一定大量存在的一组离子是
 A. K+、NO3-、Na+
B. Cl-、SO42-、Na+
A. K+、NO3-、Na+
B. Cl-、SO42-、Na+
C. SO42-、Br-、Cu2+ D. Na+、CO32-、K+
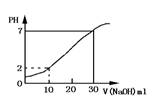
17、如右图为10mL一定物质的量浓度的盐酸X用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是
18、在25ºC时,将两个石墨电极插入一定量的硫酸钠饱和溶液中进行电解,当阳极有a mol气体产生时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为
A.![]() ×100%
B.
×100%
B.![]() ×100%
×100%
C.![]() ×100% D.
×100% D.![]() ×100%
×100%
19、以Pt作电极,用电源串联电解分装在两个烧杯里的200 mL 0.3 mol/L NaCl溶液和300 mL 0.1 mol/L的AgNO3溶液,当转移电子0.04mol后取出电极,将两杯混合,则混合溶液的pH值
A. <7 B. >7 C. =7 D. ≥7
20、向a mL浓度为0.2 mol/L的AlCl3溶液中加入金属钠,完全反应后,恰好只生成NaCl和NaAlO2的溶液,则加入钠的物质的量是
A. 2.5a×10-4mol B. 4a×10-4mol
C. 7.5a×10-4mol D. 8a×10-4mol

![]() 高二年级第三次月考
高二年级第三次月考
化学试题答题卡
| 1—10 | 11—20 | 21 | 22 | 23 | 24 | 25 | 总分 |
一、选择题,每题仅一项正确答案,每题2分,共计20分。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二、选择题,每题仅一项正确答案,每题3分,共计30分。
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
三、填空题(共计32分)
21、(14分)为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸。甲同学的设计思路是
。
(2)乙同学接着甲的实验,向烧杯中滴加CuSO4溶液,进而观察到的现象是 , 。
乙同学作出锌、铜金属活动性相对强弱所依据的原理是
, 。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了CuSO4溶液。反应随即开始,实验中有关化学反应方程式为 :
。
实验现象是 。
22、(8分)如图所示,为相互串联的甲乙两电解池,试回答:
(1)甲池若为用电解原理精炼铜的装置,A材料为_____ 。
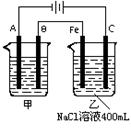 (2)写出乙池中发生反应的化学方程式
(2)写出乙池中发生反应的化学方程式
____ 。
(3)若甲槽A极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为_ L,若乙槽剩余液体为400mL,则电解后得到碱液的pH为_ 。
23、(10分,)
(1) 某烷烃的分子中含有13对共用电子,则该烷烃的分子式为 。
(2) 某烷烃的相对分子质量为100,则该烃分子为 。
(3)1体积的某气态烷烃与相同状况下的12体积Cl2发生取代反应,生成仅含碳和氯两种元素的化合物,则该烷烃的分子式是 ,该烷烃的某
个分子只存在一种一氯代物,则该分子的结构简式是 。
(4)将O2、C2H6、Na2O2放入密闭容器中,在150℃时,电火花引发反应后,容器中的压强为零,将残留物溶于水,无气体逸出,则各物质的物质的量之比为 n(O2):n(C2H6):n(Na2O2)= 。(填最简单的整数比)
四、计算题(共计18分)
24、(8分)一定量的CH4燃烧后的产物是CO、CO2、H2O(g),此混气体的质量67.2g,当其缓缓通过足量的无水CaCl2时,气体质量减少36g,则
(1)生成物中n(CO):n(CO2)= ; (2)m(CO2)= g;
(3)反应中消耗的V(CH4):V(O2)= ;
(4)若使甲烷完全燃烧还需要O2的物质的量为 mol。
25、(10分)室温下,有PH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。(已知:lg2=0.3) ,则:
(1)原混合溶液中Ba(OH)2的物质的量浓度是 mol/L,
NaOH的物质的量浓度是 mol/L。
(2)当滴到沉淀不再增加时,溶液的PH 。(设体积可以加和)
高二年级第三次月考
化学试题答案
一、选择题,每题仅一项正确答案,每题2分,共计20分。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | D | B | B | D | B | C | A | A |
二、选择题,每题仅一项正确答案,每题3分,共计30分。
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | C | D | D | B | D | A | B | D |
21(每空2分,共14分)
(1)锌能置换出酸中的氢而铜不能。(2分)
(2)锌片上有红色物质析出,(2分)
锌片上产生气泡的速率明显加快。(2分)
活泼金属可将不活泼金属从其盐溶液中置换出来,(2分)
Zn、Cu,稀硫酸组成原电池,Zn为负极。(2分)
![]() (3)2CuSO4 +
2H2O 2Cu
+ O2↑+ 2H2SO4 (2分)
(3)2CuSO4 +
2H2O 2Cu
+ O2↑+ 2H2SO4 (2分)
阴极上有红色铜析出,阳极放出气体。(2分)
22、(每空2分,共8分)
![]() (1)纯铜片
(1)纯铜片
(2)2NaCl + 2H2O 2H2↑+ Cl2↑+ 2NaOH(条件不写、气体符号不写分别扣1分)
(3)4.48 (4)14
23、(每空2分,共10分)
(1) C4H10 (2) C7H16
(3) C5H12,C(CH3) 4 (4)1:1:5
24、(每空2分,共8分)
(1) n(CO):n(CO2)=4:1 (2)m(CO2)= 8.8g
(3) V(CH4):V(O2)=5:8 (4)0.4mol
25. (共10分) (1) c[Ba(OH)2]=0.025 mol/L c(NaOH)=0.05 mol/L (每空3分,)
(2) 12.4(4分)