高二年级化学下学期期末联考试卷
化学试卷
注意事项:
1.本试卷共8页,满分110分,考试时间90分钟
2.答卷前,考生必须在试卷答题卡的密封线内将自己所在学校、姓名、班级、考号填写上
3.将第I卷和第II卷的答案均填写在试卷答题卡相应的位置上
4.答题时可能用到的相对原子质量(原子量):H-1 C-12 O-16 Na-23
第I卷(共54分)
以下1至18题,每小题给出的四个选项中,只有一个选项符合题意. 每小题3分,共54分.
1. 2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措中违背了这一指导思想的是
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,降低机动车辆尾气中有害气体排放
C.生产、生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
2. 有机物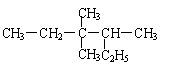 的正确命名为
的正确命名为
A.2-乙基-3,3-二甲基戊烷 B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷 D.3,4,4-三甲基己烷
3.化学是一门实用的中心学科,我们的生活离不开化学,下列有关说法中不正确的是
A.甘蔗渣可经化学反应制得酒精
B.太阳能电池可采用硅材料制作,其应用有利于环保、节能
C.棉花、蚕丝和人造丝的主要成分都是纤维素
D.不能用米汤检验食用碘盐中的碘酸钾
4.关于下列装置图的叙述中,不正确的是
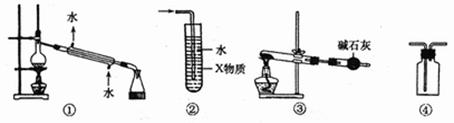
A. 装置①可用于石油的分馏实验
B.装置②中X若为四氯化碳,可用此装置吸收![]() 或HCl,并防止发生倒吸
或HCl,并防止发生倒吸
C.以![]() 为原料,在实验室中可用装置③制备少量
为原料,在实验室中可用装置③制备少量![]()
D.装置④可用于收集![]() 等气体
等气体
5. 2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质.下列关于蛋白质的说法中正确的是
A.蛋白质属于天然高分子化合物,组成元素只有C、H、O、N
B.用浓Na2SO4、CuSO4溶液或浓HNO3溶液使蛋清液发生盐析,进而分离、提纯蛋白质
C.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应
D.蛋白质水解产生的甘氨酸(H2N-CH2-COOH)既显酸性,又显碱性,是最简单的氨基酸
6. 在氯化钠晶体中,每个Na+同时吸引着距离最近的几个Cl-
A.4 B.6 C.8 D.12
7.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(CH3COOH) | 饱和Na2CO3溶液 | 分液 |
| D | 苯(苯酚) | 溴水 | 过滤 |
8. 油脂是人类的三大营养物质之一,以下有关油脂的叙述中,错误的是
A.油脂属于酯类 B.某些油脂兼有酯和烯烃的一些化学性质
C.油脂的氢化又叫油脂的硬化 D.油脂是纯净物,不是混合物
9.类推的思维方法在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证. 以下类推的结论正确的是
A.二氧化碳能形成干冰这样的分子晶体,二氧化硅也属于分子晶体
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推知“2Fe+3I2=2FeI3”反应也能发生
D.乙醛能被新制的氢氧化铜悬浊液氧化,可推知乙醛也能被酸性高锰酸钾溶液氧化
10.下列物质发生变化时,所克服的粒子间相互作用力属于同种类型的是
A.液溴和苯分别受热变为气体 B.晶体碘和氯化铵分别受热变为气体
C.石墨和铁分别受热熔化 D.氯化钾和葡萄糖分别溶解在水中
11.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压下,22.4L 甲醛的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,15.6 g Na2O2与过量的CO2反应时,转移的电子数为0.2NA
⑤体积为1L浓度为1mol·L-1FeCl3溶液中含Fe3+为NA
⑥12 g金刚石晶体中含有碳碳键的数目为4NA
A.①②⑥ B.②④⑤ C.②④ D.⑤⑥
12.人类日常生活中的吃、穿、用均离不开糖类,下列关于糖的说法中正确的是
A.符合Cn(H2O)m通式的物质一定属于糖类
B.不符合Cn(H2O)m通式的物质一定不属于糖类
C.麦芽糖分子中不含醛基,属于非还原性糖
D.淀粉、纤维素的通式为(C6H10O5)n,均为天然高分子化合物
13.下图a、b、c、d、e、f为元素周期表中前4周期相邻的一部分元素,下列有关叙述正确的是
| a | ||||
| b | c | |||
| d | e | |||
| f |
A.b、c、e三种元素的原子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物比f的氢化物的沸点低
D.f元素的氢化物不是强电解质
14.某烃的衍生物A,分子式为C6H12O2. 实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应. 由此判断A的可能结构有
A.6种 B.4种 C.3种 D.2种
15.下列离子方程式书写正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-+2H2O=AlO2-+H2↑
B.醋酸铵溶液和盐酸反应:CH3COONH4+H+ = CH3COOH+NH4+
C.向乙醇中加入金属钠:2CH3CH2OH+2Na→2CH3CH2ONa+ H2↑
D.向澄清石灰水中加入过量的碳酸氢钠溶液: Ca2++2OH-+2HCO3-= CaCO3↓+2H2O+CO32-
16.蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品乳化剂. 某蔗糖酯是由蔗糖与硬脂酸乙酯合成,反应如下:
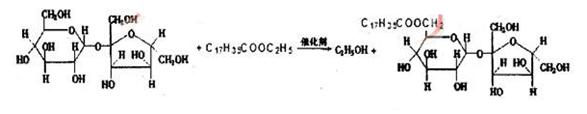
以下有关说法不正确的是
A.蔗糖酯是高级脂肪酸和糖形成的酯
B.合成该蔗糖酯的反应属于取代反应
C.蔗糖分子中含有8个羟基
D.该蔗糖酯在稀硫酸的作用下水解,水解过程中只有硬脂酸和葡萄糖两种产物
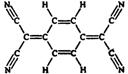 17.目前,世界上已合成了几百万种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示. 下列关于TCNQ说法错误的是
17.目前,世界上已合成了几百万种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示. 下列关于TCNQ说法错误的是
A.TCNQ分子中所有原子都在同一平面上
B.TCNQ属于苯的同系物
C.TCNQ分子中既含极性键又含非极性键
D.TCNQ分子中碳原子和氮原子的最外层均达到8电子稳定结构
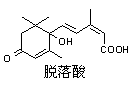 18.已知(CH3)2C=CH2可用键线式表示为
18.已知(CH3)2C=CH2可用键线式表示为![]() ,脱落酸属植物生长抑制剂,其结构如下图,对该物质的叙述中正确的是
,脱落酸属植物生长抑制剂,其结构如下图,对该物质的叙述中正确的是
A.分子式为C15H22O4
B.属于芳香族化合物
C.1mol该物质最多可与3mol H2发生反应
D.在一定条件下发生反应生成含七元环的物质
第II卷(共56分)
![]()
![]() 19 (本题共22 分).I .下列实验操作或对实验事实的叙述中,正确的在括号内打 ,错误的在括
19 (本题共22 分).I .下列实验操作或对实验事实的叙述中,正确的在括号内打 ,错误的在括
号内打X
( )⑴ 实验室制取乙烯时,必须将温度计的水银球插入反应液液面以下,根据温度计指示的温度来调节酒精灯火焰大小,以控制反应液的温度.
( )⑵在洁净的试管里加入1mL2%的氨水, 然后一边摇动试管, 一边逐滴滴人2%的硝酸银溶液,至最初产生的沉淀恰好溶解为止, 即得银氨溶液.
( )⑶用稀硝酸清洗做过银镜反应实验的试管.
( )⑷实验室制肥皂时,将适量植物油和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂.
( )⑸进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可.
II. 现安装一套实验室利用液一液反应制备气体的装置,有人设计了五步操作,请你安排出正确而简捷的程序, 将序号(1、2、3…)填入括号内.
( )将蒸馏烧瓶固定在铁架台上.
( )把酒精灯放在铁架台上, 根据酒精灯确定铁圈的高度, 固定铁圈, 放好石棉网.
( )用漏斗向蒸馏烧瓶中加入一种液体反应物, 再向分液漏斗中加入另一种液体反应物, 并将导气管放入气体收集器中.
( )检查装置的气密性(利用对固定装置进行微热的方法来检查气密性. 假定瓶口漏气而需要更换橡皮塞).
( )在蒸馏烧瓶上装好分液漏斗, 连接好导气管.
|
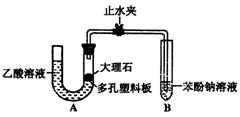
探究乙酸、碳酸和苯酚的酸性强弱关系
该校学生设计了右图的实验装置(夹持仪器已略去).
⑴某生检查装置A的气密性时,先关闭止水夹,从左
管向U型管内加水,至左管液面高于右管液面,静置
一段时间后,若U型管两侧液面差不发生变化,则气
密性良好. 你认为该生的操作正确与否? (填“正确”或“错误”)
大理石与乙酸溶液反应的化学方程式为
⑵装置A中反应产生的气体通入苯酚钠溶液中,实验现象为
反应的离子方程式为
⑶有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚. 改进该装置的方法是
证明乙酸为弱酸
⑷现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸
确定几种盐溶液pH大小的关系
⑸在相同温度下,测定相同物质的量浓度 a.NaHCO3溶液 b.Na2CO3溶液 c. CH3COONa溶液 d. ![]() -ONa溶液的pH, 其pH由大到小排列的顺序为 (填溶液编号)
-ONa溶液的pH, 其pH由大到小排列的顺序为 (填溶液编号)
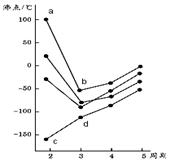 20.(本题共 8分) 下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,试完成下列问题:
20.(本题共 8分) 下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,试完成下列问题:
(1)a点表示的氢化物的分子式为
(2)d点表示的氢化物的分子式为 ,它属于 分子(填“极性”或“非极性”),氢化物d的沸点比氢化物c的沸点高,是因为:
21.(本题共 8分) 实验室以常温均为气态的X和Y为反应物合成有机物Z.当向密闭容器中充入2mol X和1mol Y.在一定条件下建立如下平衡:2X(g)+Y(g)![]() Z
(g)
Z
(g)
(1)其他条件不变,向上述平衡体系中再充一定量的Z,重新建立平衡的过程中正反应速率如何变化? (填“加快”、“减慢”或“不变”). 重新建立平衡后与原平衡相比,X的体积分数将 (填“增大”、“减小”或“不变”)
(2)“绿色化学”是21世纪化学发展的主导方向.“绿色化学”要求从根本上消灭污染. 其中“化学反应的绿色化”要求原料物质中所有的原子完全被利用且全部转入期望的产品中. 若上述反应是工业生产中按“绿色化学”要求合成的有机物Z是甲醇,则X为 Y为
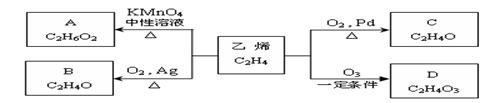 22.(本题共8 分) 乙烯在不同的条件下可被氧化成不同的产物. 如下图所示:
22.(本题共8 分) 乙烯在不同的条件下可被氧化成不同的产物. 如下图所示:
![]() 请回答下列问题:
请回答下列问题:
(1)已知烯醇很不稳定,很快会发生异构化,形成稳定的羰基( )化合物,如:
RCH=CH-OH→R-CH2-CHO。取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
写结构简式:A B
写出C发生银镜反应的化学方程式
(2)D有多种同分异构体,其中有一种叫过氧乙酸,过氧乙酸具有很强的氧化性和腐蚀性,可作防治禽流感的药物。则过氧乙酸的结构简式为
23.(本题共4 分) 两个![]() 氨基酸分子脱水形成的含有肽键
氨基酸分子脱水形成的含有肽键 ![]() 的化合物称为二肽,二肽还可以继续与其它
的化合物称为二肽,二肽还可以继续与其它![]() 氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成 种二肽.若上述两种
氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成 种二肽.若上述两种![]() 氨基酸可形成一种C27 H46O11
N10的多肽,则参加反应的丙氨酸与甘氨酸的物质的量之比为 :
.
氨基酸可形成一种C27 H46O11
N10的多肽,则参加反应的丙氨酸与甘氨酸的物质的量之比为 :
.
24.(本题共6 分) 近日,油炸薯条再次出现食品安全危机,因为其中反式脂肪酸(trans fatty acids简称TFA)的含量增加了1/3. 中国食疗网发布“反式脂肪酸预警报告”,报告称:摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病. 顺式脂肪酸、反式脂肪酸的结构如图所示.
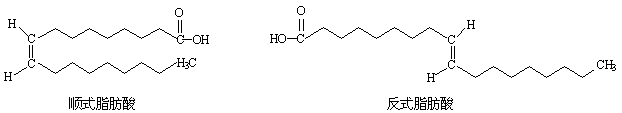
试回答下列问题:
(1)顺(反)式脂肪酸中所含官能团名称是 (任填一种).
(2)上述顺式脂肪酸和反式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为
A.同分异构体 B.同系物 C.同一种物质 D.同素异形体
(3)研究表明,在特定的条件下,顺式脂肪酸与反式脂肪酸会产生互变,油脂长时间高温加热及油脂催化加氢都会使反式脂肪酸的含量增高.
据专家介绍,多食用花生油对人体有益,是因为花生油中含反式脂肪酸较少,且含有对人体有抗癌作用的白藜芦醇(化学名称为芪三酚),其结构简式为: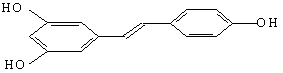
试写出1mol白藜芦醇与足量溴水发生反应的化学方程式: