高二年级化学与生活学业水平测试补考卷
试 题
(考试时间:90分钟 满分:100分)
相对原子质量:H:1 O:16 S:32 Zn:65
一、选择题(每小题只有一个选项符合题意,共40分)
1.下列有关蛋白质的叙述中,不正确的是:
A. 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解
B. 人工合成的具有生命活性的蛋白质—结晶牛胰岛素,是1965年我国科学家最先合成的
C. 重金属盐能使蛋白质变性,所以误食重金属盐会中毒
D. 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应
2.下列家庭化学小实验不能达到预期目的的是:
A.用米汤检验食用加碘盐(含KIO3)中含有碘
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验汽油中是否含有不饱和烃
D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
3.蛋白质发生的下列过程中,可逆的是:
A.变性 B.煮熟 C.盐析 D. 加入浓硫酸
4.维生素C具有的性质是:
A.难溶于水 B.强还原性 C.强氧化性 D. 加热难分解
5.“垃圾是放错了地方的资源”,应分类回收利用。生活中废弃的塑料袋、废纸、旧橡胶制品等属于:
A.无机物 B.有机物 C.盐类 D. 糖类
6.关于合理饮食有利于健康的下列说法正确的是:
A.没有水就没有生命 B.饮用水越纯净越好
C.养成良好的饮食习惯,多吃蔬菜、水果等碱性食物
D. 调味剂和营养剂加得越多越好
7.下列防止金属腐蚀的做法不可行的是
A.在某些工具的机械转动部位刷油漆以防锈
B.衣架和电线外面包上一层塑料层以防锈
C.在钢材制造的大型船舶上装上一定数量的锌块。
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
8.制造焊锡时,把铅加入锡的重要原因是:
A.增加强度 B.降低熔点 C.增加硬度 D. 增强抗腐蚀能力
9.钢铁发生吸氧腐蚀时,正极上发生的电极反应是:
A.2H+ + 2e- === H2↑ B.Fe2+ + 2e- == Fe
C.2H2O + O2 + 4e- === 4OH- D. Fe3+ + e- === Fe2+
10.光导纤维的主要成分是:
A.纯硅 B.玻璃 C.纯SiO2 D. 沙子
11.区分羊毛织品和尼龙布最简单的方法是
A.灼烧并闻气味 B.观察外观
C.放在水中比较柔软性 D.手摸,凭手感区分
12.普通玻璃的主要成分是:①Na2SiO3 ②CaCO3 ③CaSiO3 ④SiO2 ⑤Na2CO3 ⑥CaO
A. ①③⑥ B.②③④ C. ①③④ D.③④⑤
13.酸雨是指:
A.酸性的雨 B.pH=5.6的雨 C.pH<5.6的雨 D.pH=5的雨
14.饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是:
A.鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B.水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C.米饭含有大量的淀粉,成人每天食用量不能超过200 g
D.要促进身体健康,各种饮食必须合理搭配
15.下列不是室内污染物的是:
A.CO B.甲苯 C.尼古丁 D. 食品袋
16.下列塑料可以用于食品袋的是
A.聚丙烯腈 B.聚乙烯 C.聚氯乙烯 D.聚丙烯
17.下面不是污水处理方法的是:
A.过滤法 B.混凝法 C.中和法 D. 沉淀法
18.“白色污染”的主要危害是:
①破坏土壤结构 ②降低土壤肥效 ③污染地下水 ④危及海洋生物的生存
A.①② B.②③ C. ①②③④ D. ②④
19.垃圾资源化的方法是:
A.填埋 B.焚烧 C.堆肥 D.分类回收
20.某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的:
A.食盐、硫酸 B.胆矾、石灰水 C.铁粉、生石灰 D.苏打、盐酸
二、选择题(每小题有一个选项符合题意,每小题3分,共15分,请把答案填入答卷的相应位置)
21.下列反应可用于测定患糖尿病者尿液中含葡萄糖的是:
A.加入金属钠看是否放出H2
B.与新制碱性Cu(OH)2悬浊液混合煮沸看是否有红色沉淀
C.放置后看是否有白色晶体生成
D.加苯振荡、静置后,看是否分层
22.下列金属中在常温下不溶于浓硝酸的是:
A.锌 B.镁 C.铝 D.铜
23.往蛋白质溶液里加入下列物质会产生沉淀,但再加水稀释,沉淀不会溶解的是:
A.Na2SO4 B.NaCl C.CuSO4 D.NH4Cl
24.钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是:
A.用来做保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于制造船舶
25.下列离子方程式的书写不正确的是:
A. 跟稀硫酸反应: Fe + 2H+ = Fe2+ + H2↑
B. Ca(HCO3)2溶液和盐酸反应: Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
C.醋酸跟氢氧化钾溶液反应: CH3COOH + OH- = CH3COO- + H2O
D.MgCO3跟稀硫酸反应:MgCO3 + 2H+ = Mg2++ H2O + CO2↑
三、填空题(本题2小题,每空2分,共28分)
26.淀粉的化学式是: ;检验土豆中含有淀粉的化学试剂是: ;钢含碳量为: ;玻璃、陶瓷、水泥一定含 元素;造成赤潮的元素是: 。油脂在体内水解后的产物是: 。
27.NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1) NO对环境的危害在于 (填以下项目的编号)
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2) 在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸
根离子在酸性水溶液中反应的离子方程式 。
28.金属的防腐常用方法有: A.覆盖机油 B.覆盖油漆 C.覆盖塑料 D.电镀金属 E.电化学保护法 F.制成不锈钢。请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号): (1)邮筒_________ (2)手术刀________ (3)海水中的钢闸门________
(4)电线__________ (5)铁钳的转动部位________ (6)自行车的钢圈____________。
四、实验探究(共6分)
29.如何设计实验证明维生素C具有还原性。要求写出实验所用的试剂、现象和结论。
五、计算题(本题2小题,共11分)
30.(5分) 煤等化石燃料燃烧时产生的SO2会对大气造成污染。若某家庭取暖每天燃烧6 kg 煤,煤中硫元素的质量分数为1%。假设煤中的硫全部转化为SO2,试计算每天产生的SO2的物质的量是多少?
31.(6分) 由锌和铜构成的合金共 18 g ,放入足量的稀盐酸中充分反应,产生标准状况下气体2.24L,试求合金中锌的质量分数。
 《化学与生活》答题卷
《化学与生活》答题卷
一、选择题(2×20 =40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、选择题(3×5 =15分)
| 题 号 | 21 | 22 | 23 | 24 | 25 |
| 答 案 |
三、填空题(本题2小题,每空2分,共28分26. ; ; ; ; ;
27.(1) (2) 。
28.(1) (2) (3) (4) (5) (6) 。
四、实验探究(共6分)
29. 试剂:
现象、结论:
。
五、计算题(本题2小题,共11分)
30.(4分)
31.(7分)
友情提醒:试题结束,请认真检查。
![]()
| |
 《化学与生活》模块考试答案
《化学与生活》模块考试答案
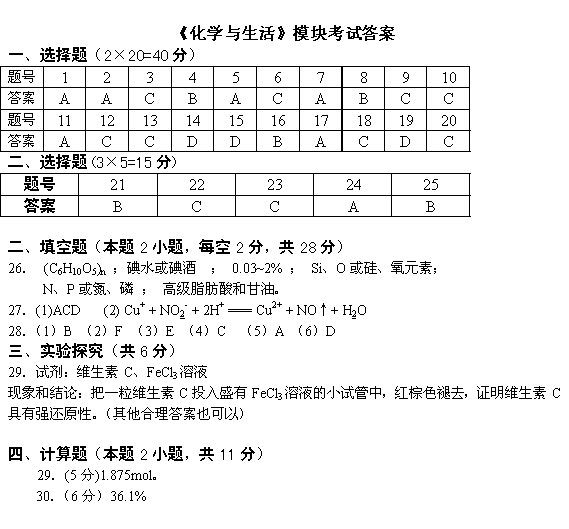
一、选择题(2×20=40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | C | B | A | C | A | B | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | C | C | D | D | B | A | C | D | C |
二、选择题(3×5=15分)
| 题号 | 21 | 22 | 23 | 24 | 25 |
| 答案 | B | C | C | A | B |
二、填空题(本题2小题,每空2分,共28分)
26. (C6H10O5)n ;碘水或碘酒 ; 0.03~2% ; Si、O或硅、氧元素;
N、P或氮、磷 ; 高级脂肪酸和甘油。
27.(1)ACD (2) Cu+ + NO2- + 2H+ === Cu2+ + NO↑+ H2O
28.(1)B (2)F (3)E (4)C (5)A (6)D
三、实验探究(共6分)
29.试剂:维生素C、FeCl3溶液
现象和结论:把一粒维生素C投入盛有FeCl3溶液的小试管中,红棕色褪去,证明维生素C具有强还原性。(其他合理答案也可以)
四、计算题(本题2小题,共11分)
29.(5分)1.875mol。
30.(6分)36.1%