高二化学第一学期期末调研考试试题(选修)
(命题人:殷志宁 审核人:陈克志 姚志红)
本试卷包括六大题,25小题,满分120分,考试时间为:100分钟
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 | |||||||
| 评卷人 |
注意事项:1.答卷前,考生务必将密封线内各项填写清楚。
2.用钢笔或圆珠笔直接在试卷上答题。
3.选择题答案填在下列指定的答案栏内。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
可能用到的相对原子质量:H一1 C—12 O-16 Cl—35.5
一、单项选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1.卫生部发出公告,提醒人们慎食油炸薯条,因为其中含有剧毒的丙烯酰胺。已知乙
酰胺的结构简式为CH3CONH2 ,苯甲酰胺的结构简式为:C6H5CONH2 。
则丙烯酰胺的结构简式为
A.CH3CH2 CONH2 B.CH3CH2COONH4
C.CH2=CHCONH2 D.CH2=CHCONH4
2.由2一氯丙烷为主要原料制l,2一丙二醇CH3CH(OH)CH2OH时,经过的反应为
A.加成一消去一取代 B.消去一加成一取代
C.取代一消去一加成 D.取代一加成一消去
![]() 3.某烃分子中有一个由C—C键构成的六元环,有一个C=C键,还有一个C C键,
3.某烃分子中有一个由C—C键构成的六元环,有一个C=C键,还有一个C C键,
 则能满足上述条件的烃的分子式可能是
则能满足上述条件的烃的分子式可能是
A.C8H10 B.C10H16 C.C12H22 D.C14H22
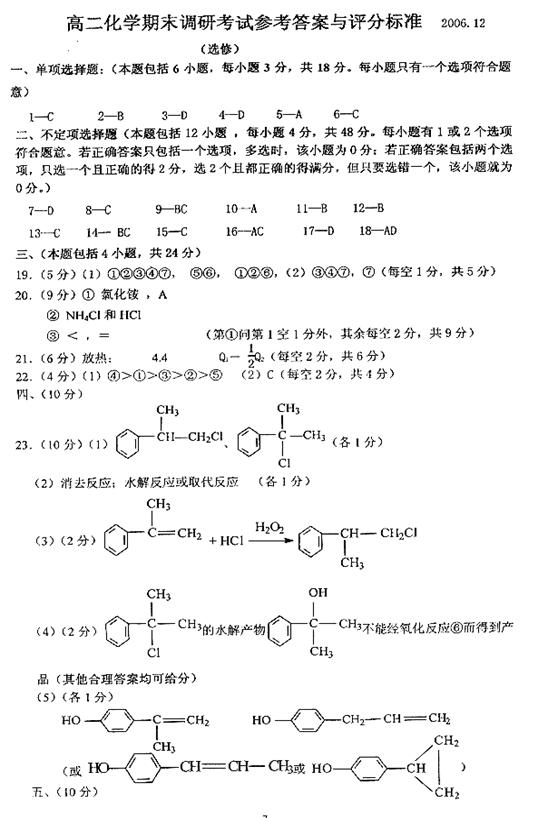
4.由两种气态烃组成的混合物的总物质的量与该混合物完
全燃烧后所得气体产物(CO2和水蒸气)的物质的量的变
化关系如图所示,则以下对其组成的判断正确的是
A.一定没有丙炔 B.一定没有乙烯
C.一定有乙烯 D.一定有甲烷
5.碳酸铵在室温下就能自发地分解产生氨气,对其说法中正确的是
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解的热化学方程式为(NH4)2CO3=NH4HCO3+NH3 △H=+74.9kJ/mol
C.凡是放热反应都是自发的,凡是吸热反应都是非自发的
D.碳酸盐都不稳定,都能自发分解
6.下列燃烧反应的反应热为其燃烧热的是(下列均为25℃,10lkPa时的数据)
A.C(s)+1/2O2(g)=CO(g) △H=-110.5kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/mol
C.S(s)+O2(g)=SO2(g) △H=-296.9 kJ/mol
D.1/2N2H4(g)+1/2O2(g)=l/2N2(g)+H2O(1) △H=-311 KJ/mol
二、不定项选择题(本题包括12小题,每小题4分,共48分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项。多选时,该小题为0分;若正确答案包括两个选项。只选一个
且正确的得2分,选2个且都正确的得满分。但只要选错一个,该小题就为0分。)
7.1mol某烃跟73gHCl加成生成卤代烷,生成的卤代烷跟Cl2发生取代反应,若卤代烷与
Cl2的物质的量之比为l:l0发生完全取代,生成只含二种元素的有机物,则该烃是
A.2一丁烯 B.2一戊烯 C.1,3一丁二烯 D.2一甲基一l,3一丁二烯
8.将气体A2、B2各1mol充入1L的密闭容器中反应生成气体C,一段时间后,测得c(A2)为
0.58mol/L,c(B2)为0.16 mol/L,c(C)为0.84 mol/L,则C的化学式为
A.AB B.A2B C.AB2 D.A2B2
9.用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,未用盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
10.在相同温度下,甲酸和乙酸都是弱酸,当它们物质的量浓度均为0.10mol·L-1时,甲酸溶液中
的c(H+)约为乙酸溶液中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol·L-1
的乙酸溶液,经测定它们的pH从大到小依次为a、乙酸溶液、b 。由此可知
A.a的物质的量浓度必小于乙酸的物质的量浓度
B.a的物质的量浓度必大于乙酸的物质的量浓度
C.b的物质的量浓度必小于乙酸的物质的量浓度
D.b的物质的量浓度必大于乙酸的物质的量浓度
11.已知碳碳单键可以绕键轴自由旋转,某烃结构简式如下图所示,下列说法正确的是
![]() A.该烃的相对分子质量为216
A.该烃的相对分子质量为216
B分子中可能有11个碳原子处于同一平面上
C.该烃属于苯的同系物
D.该烃苯环上的一氯代物只有一种
12.在由水电离出来的c(H+)=l×10-14mol/L的溶液中,一定能大量共存,且溶液为无色
的离子组是
A.NH4+、Fe3+、Cl-、NO3- B.Na+、Ba2+、Cl-、NO3-
C.K+、Mg2+、HCO3-、SO42- D.K+、Na+、MnO4-、SO42-
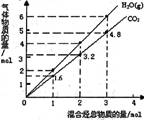
 13.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸
13.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸
中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
14.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
A.H2Y的电离方程式:H2Y![]() 2H++Y2-。
2H++Y2-。
B.HY-水解的离子方程式:HY-+H2O![]() H2Y+OH-
H2Y+OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D.该酸式盐溶液中离子浓度关系:c(H+)+2c(H2Y)===c(OH-)+2c(Y2-)
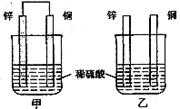
 15.在容积固定的4L密闭容器中,进行可逆反应:
15.在容积固定的4L密闭容器中,进行可逆反应:
X(g)+2Y(g)![]() 2Z(g)并达到平衡,在 此过程中,
2Z(g)并达到平衡,在 此过程中,
以Y的物质的量浓度改变表示的反应速率υ正、υ逆
与时间t的关系如图所示。则图中阴影部分的面积表示
A.X的物质的量浓度的减少
B.Y的物质的量的减少
C.Z的物质的量浓度的增加
D.X的物质的量的减少
16.在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的物质的量浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的物质的量浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
17.某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl):n(H2SO4)=3:1。若以
石墨作电极长时间电解该溶液,下列推断中不正确的是
A.阴极产生的气体为H2 B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终常温下大于7 D.整个电解的过程实质是电解水
18.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+Br2(g)![]() 2HBr(g), 已知加入lmol H2和2mol Br2时,反应达到平衡后,生成amol
2HBr(g), 已知加入lmol H2和2mol Br2时,反应达到平衡后,生成amol
HBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),
如果仍保持平衡后各组分的物质的量分数不变,以下推断不正确的是
A.x、y、z应满足的关系是y=2x+z B.x、y、z应满足的关系是4x十z=2y
C.达到平衡时HBr物质的量为(x+y+z)a/3 D.达到平衡时HBr物质的量一定仍为amol
三、(本题包括4小题,共24分)
![]()
![]() 19.(5分)按要求对下列化合物进行分类:
19.(5分)按要求对下列化合物进行分类:
①CH3CH2CH3 ②CH2=CH2 ③CH3CH2OH ④CH3CH2Br ⑤ ⑥
⑦CH3COOCH2CH3
(1)按碳的骨架分类,属于链状化合物的是(填写编号,下同) 。属于环状化合物的
是 属于脂肪烃的是 。
(2)按照组成元素、官能团和结构特点分类,属于烃的衍生物的是
其中属于酯的是
20.( 9分)已知某溶液中只存在OH-、H+、NH4+、Cl四种离子,某同学推测该溶液中各离子
浓度大小顺序可能有如下四种关系:
A.c(C1-)>c(NH4十)>c(H+)>c(OH-) B.c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.c(C1-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,这种溶质的名称是 ,该溶液中离子浓度大小顺序
关系是(选填序号)
②若上述关系中C是正确的,则溶液中溶质的化学式是
③若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O) (填“>”、“<”、或“=”,下同)混合后溶液中c(NH4+)与
 c(Cl-)的关系是c(NH4+) c(Cl-)。
c(Cl-)的关系是c(NH4+) c(Cl-)。
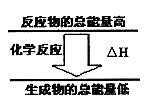
21.(6分)(1)化学反应中均伴随着能量的变化。如果一个化学反应中,
反应物的总能量和生成物的总能量有如图所示的关系,则该反应
过程中的能量变化是 (填“放热”或“吸热”)
已知热化学方程式为:
C(s)+O2(g)===CO2(g) ; △H=-393.5 kJ/mol
H2(g)+1/2O2(g)===H2O(l) ; △H=-285.8kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比值是 (保留1位小数)。
(2) 已知Mg(s)+1/2O2(g)=MgO(s);△H=Q1 , 2Hg(l)+O2(g)=2HgO(s) ;△H=Q2
现有反应Mg(s)+HgO(s)=Hg(L)+MgO(s) ;△H=Q3。则Q3应为
(用含Q1、Q2的式子表示)
22.(4分)(1)对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类
似于c(H+)·c(OH-)=Kw,存在等式c(M+)·c(X-)=Ksp。现将足量的AgCl分别放
入下列物质中,AgCl的溶解度由大到小的排列顺序是 (填序号)
①20mL0.01mol/LKCl溶液 ②30mL0.02mol/LCaCl2溶液
③40mL0.03mol/LHCl溶液 ④10mL蒸馏水⑤50mL0.05mol/LAgNO3溶液
(2)向5mL NaCl溶液中滴人一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振
荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,
分析此三种沉淀物的溶解度关系为
A.AgCl=AgI=Ag2S B.AgCl<AgI<Ag2S
C.AgCl>AgI>Ag2S D.AgI>AgCl>Ag2S
四、(10分)
23.(10分)已知:1.有机化学反应因反应条件不同,可生成不同的有机产品。
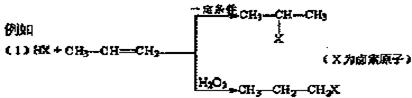
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;
若在催化剂作用下,苯环上的氢原子被卤素原子取代。
![]() 2.
在铜或银作催化剂的条件下,被空气中氧气氧化不能生成CH3CH2CHO。
2.
在铜或银作催化剂的条件下,被空气中氧气氧化不能生成CH3CH2CHO。
![]() 工业上利用上述信息,按下列路线合成结构简式为
的物质,该物质是一种香料。
工业上利用上述信息,按下列路线合成结构简式为
的物质,该物质是一种香料。
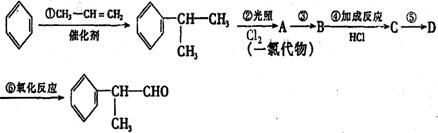
请根据上述路线,回答下列问题:
(1) A中的一氯代物有两种,它们的结构简式为 和
(2) ③、⑤的反应类型分别为 、
(3) 反应④的化学方程式为(有机物写结构简式,并注明反应条件):
(4) 工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,
其原因是 。
(5) 这种香料具有多种同分异构体,其中某些物质有下列特征:
①含有酚羟基 ②分子中有苯环,且苯环上的一溴代物有两种。
写出符合上述条件的物质可能的结构简式(只写两种): , 。
五、(10分)
24.(10分)已知:CH3CH2OH+NaBr+H2SO4(浓)![]() CH3CH2Br+NaHSO4
+H2O。
CH3CH2Br+NaHSO4
+H2O。
 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:
(已知溴乙烷的沸点为38.4℃):
①按右图所示连接仪器装配装置,检查装置的气密性,然后向装置中的
U形管和大烧杯里加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的
13g溴化钠和几粒碎瓷片
③小火加热,使其充分反应,
回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体化学式为
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,
待液体分层后,取 (填“上层”或“下层”) 液体。
为了除去其中的杂质,最好选择下列试剂中的 (填序号)。
a.Na2SO3溶液 b.H2O c.NaOH浓溶液 d.CCl4
要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行
(填操作名称)。
(3)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:
取少量溴乙烷,然后 (填代号)。
①加热; ②加入AgNO3溶液; ③加入稀HNO3酸化; ④加入NaOH溶液; ⑤冷却。
请写出在此过程中,有溴乙烷参加的反应的化学方程式 ,
检验此反应中有机产物可用 的方法。
六、(10分)
25.(10分)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:
Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
(1)若用此电池作电源电解足量的M(NO3)x溶液(用碳棒作电极材料),电解池的阳极
应连接 (填序号) ①NiO(OH) ②Cd ③Cd(OH)2 ④Ni(OH)2
电池的负极反应为
当该电池工作一段时间后消耗了3.6gH2O时,电解池某极增重m g,则金属M的相对
原子质量为 (用m、x表示)。
(2)若用此电池作电源电解含有0.1molCuSO4和0.1molNaCl的混合溶液100mL(用碳棒作电极材料),
当电路中有0.2mole-通过时,阳极产生气体多少升(标准状况)?
电解后溶液加水稀释至1L,常温下溶液的pH是多少?
|