高二化学第一学期第一次月考试题
命题人:吴兴国 审核人:方克余
可能用到的原子量:H 1 C 12 N 14 O 16 S 32 Fe 56
第Ⅰ卷(选择题 50分)
一、选择题(每小题仅有1个正确选项,每题2分,共50分)
1.对于反应:A+B![]() C下列条件的改变一定能使化学反应速率加快的是
C下列条件的改变一定能使化学反应速率加快的是
A.增加A的物质的量 B.升高体系的温度
C.增加体系的压强 D.减少C的物质的量浓度
2.在下列平衡2CrO42-(黄色)+2H+![]() Cr2O72—(橙红色)+H2O中,溶液颜色介于黄和橙红色之间,今欲使溶液的橙红色加深,则要在溶液中加入
Cr2O72—(橙红色)+H2O中,溶液颜色介于黄和橙红色之间,今欲使溶液的橙红色加深,则要在溶液中加入
A.H+ B.OH- C.K+ D.H2O
3.一定条件下向一带活塞的密闭容器中充入2molSO2和1molO2,发生如下反应:
2SO2(g) +O2(g)![]() 2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是
A.保持温度和容器的体积不变,充入1molSO2(g)
B.保持温度和容器内压强不变,充入1molAr(g)
C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molSO3(g)
4.在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时测得CO2为 0.6mol,再通入4mol水蒸气,达到平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为 0.6mol,再通入4mol水蒸气,达到平衡后,CO2的物质的量为
A.0.6mol B.1mol C.大于0.6mol D.大于1mol
5.在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是
3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是
A.4molA+2molB B.2molA+1molB+3molC+1molD
C.3molC+1molD+1molB D.3molC+1molD
6.在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)![]() C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的分子数目 D.混合气体的总物质的量
7.下列各图中能表示A(g)+B(g)![]() 2C(g)(正反应为放热反应)这个可逆反应的为
2C(g)(正反应为放热反应)这个可逆反应的为
8.在两个恒容容器中,有平衡体系:A(g)![]() 2B(g) 和2A
2B(g) 和2A![]() B(g),X1和X2分别是A的转化率。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g),X1和X2分别是A的转化率。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.X1降低 X2增大 B.X1、X2均降低 C.X1增大,X2降低 D.X1、X2均增大
9.在2A+B![]() 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
10.在一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g)进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%。则反应开始时,充入容器中的X和Y的物质的量之比为
2Z(g)进行一段时间后,测得Y的转化率为37.5%,X的转化率为25%。则反应开始时,充入容器中的X和Y的物质的量之比为
A.1:3 B.3:1 C.1:2 D.2:1
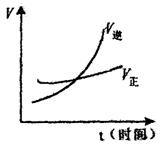 11.在一密闭容器中充入一定量的H2和N2发生反应N2+3H2
11.在一密闭容器中充入一定量的H2和N2发生反应N2+3H2![]() 2NH3,经测定3秒末的氢气的反应速率为0.3mol·L-1·S-1,则6秒末NH3的浓度为
2NH3,经测定3秒末的氢气的反应速率为0.3mol·L-1·S-1,则6秒末NH3的浓度为
A.1.2mol/L B.大于1.2mol/L
C.小于1.2mol/L D.不能确定
12.有如下反应:mA(g)![]() nB(g),当加压后,反应速率如图所示,推断系
nB(g),当加压后,反应速率如图所示,推断系
数m和n关系是
A.m>n B.m<n C.m=n D.无法确定
13.一定条件下,可逆反应N2 +3H2![]() 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D.增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数
14.在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.物质A的转化率小了 B.平衡向正反应方向移动了
C.物质B的质量分数减小了 D.a>b
15.在一密闭容器中,等物质的量的A和B发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
A.40% B.50% C.60% D.70%
16.一定温度下,在带活塞的密闭容器中,反应H2(g) +I2(g)![]() 2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
 A.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
A.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
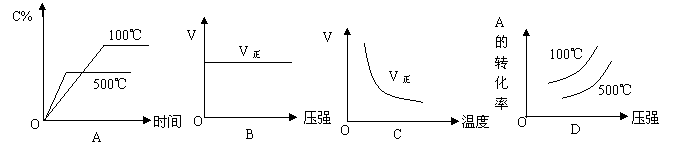 B.恒温时,减小容积平衡不移动,但气体颜色加深
B.恒温时,减小容积平衡不移动,但气体颜色加深
C.恒容时,通入H2,I2的质量分数减小
D.恒压时,通入HI气体,刚开始时正反应速率会减小
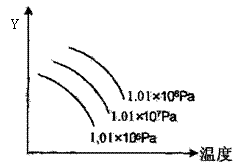
17.右图表示外界温度和压强对反应L(s)+G(g)![]() 2R(g)(正反应
2R(g)(正反应
是吸热)的影响,图中y的意义为
A.平衡混合气中R的体积分数 B.平衡混合气中G的体积分数
C.L的转化率 D.R的产率
18.已知反应:PC15![]() PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为
PC13 + C12,将1.0 mol PC15充入容积为2 L的密闭容器中,一段时间后,测得PC15的浓度为0.3 mol/L,在这段时间内的平均反应速率V(PC15)=0.4 mol/(L·min),则这段时间为
A.50 s B.30 s C.5 s D.1 s
19、下图中a曲线表示一定条件下的可逆反应 X (g) + Y (g) ![]() 2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
2Z
(g) + W(s),正反应放热的反应过程。若使a曲线变为b曲线,可采取的措施是
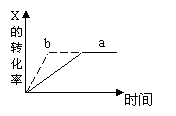 A.增大压强 B.增大X的浓度 C.升高温度 D.加入W
A.增大压强 B.增大X的浓度 C.升高温度 D.加入W
20、对于一个密闭容器中进行的可逆反应:mA(气) +
nB(气) ![]() eC(气
)+dD (气)+ Q,下列能证明该反应一定达到平衡状态的是
eC(气
)+dD (气)+ Q,下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每消耗m个A分子的同时也生成了d个D分子
C.单位时间内每生成e个C分子的同时也生成了n个B分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
21.在pH=l含![]() 离子的溶液中,还能大量存在的离子是
( )
离子的溶液中,还能大量存在的离子是
( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
22.下列物质中,导电性能最差的是: ( )
A.熔融氢氧化物 B.石墨棒 C.盐酸溶液 D.固态氯化钾
23.在CH3COOH溶液中存在如下平衡:CH3COOH
![]() H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是 ( )
H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是 ( )
A.NaOH B.CH3COONa C.Na2O D.Na2CO3
24.下列有关合成氨工业的叙述,可用 勒夏特列原理来解释的是
A.使用铁触煤,使N2和H2混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的条件
 C.500℃左右比室温更有利于合成氨的反应
C.500℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
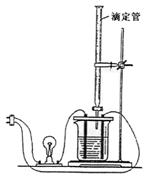
25.利用右图装置做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3 B.CH3COOH、NH3·H2O C.NaOH、AlCl3 D.H2SO4、Ba(OH)2
第Ⅱ卷(非选择题 50分)
二、填空题(本题7小题,共44分)
26、(6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如右图所示,由图中数据分析:
⑴该反应的化学方程式为
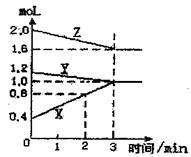 ⑵反应开始至2分钟末,X的反应速率为:
⑵反应开始至2分钟末,X的反应速率为:
⑶该反应是由 开始反应的(正、逆或正逆同时)
27.(12分)在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
⑴写出反应的化学方程式: 。
⑵再向溶液中滴入1mol/LFeC13溶液,现象 ,平衡向 反应方向移动,KSCN浓度会 。
⑶在烧杯中加入KC1固体,颜色 ,平衡 移动。
28.(8分)在一定条件下,xA + yB ![]() zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)
29.(8分)在一定条件下,可逆反应A + B![]() mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
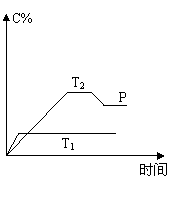 ⑴温度T1 T2(填大于、等于或小于)
⑴温度T1 T2(填大于、等于或小于)
⑵正反应是 反应(填“吸热”或“放热”)
⑶如果A、B、C均为气体,则m 2(填大于、等于或小于)
⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,
则体系的压强 (填增大、减小或不变),平衡 移
动(填“向正反应方向”、“向逆反应方向”或“不”)。
30.(10分)已知可逆反应CO + H2O(g)
![]() CO2 + H2,
CO2 + H2,
达到平衡时,K = ![]() ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化
率为60%,水蒸气的转化率为______________;K值为______________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是______________________________;
②当a = b时,a = __________c。
三、计算题(本题1小题,共6分)
31.(6分)29、工业上有一反应
![]() ,按体积比为A:B=5:2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
,按体积比为A:B=5:2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
(1)平衡时A和B的转化率。
(2)平衡时混合气体的平均分子量。
![]()

高二化学答题卷
命题人:吴兴国 审核人:方克余
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Ca 40 Fe 56 Cu 64 Ag 108
| 题号 | 一 | 二 | 三 | 总分 |
| 得分 |
一、选择题(每小题仅有1个正确选项,每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
|
|
|
|
|
|
|
二、填空题(本题5小题,共44分)
26、(6分)(1) (2)
(3)
27、(12分)
⑴
⑵
⑶
28、(8分)
29、(8分)
⑴
(2)
3)
(4) (各1分)
30、(10分)
(1)
(2)
(3)
①
②
三、计算题(6分)
31、(6分)
高二化学参考答案
选择题答题栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | A | D | C | D | B | A | A | B | C | C | B | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | B | A | A | B | B | A | C | C | D | B | B | D |
二、填空题(本题5小题,共44分)
26、(6分)(1)Y+2Z![]() 3X (2)0.1mol·L-1·min-1 (3)正逆同时开始
3X (2)0.1mol·L-1·min-1 (3)正逆同时开始
27、(12分)⑴ FeC13+3KSCN![]() Fe(SCN)3+3KC1
Fe(SCN)3+3KC1
⑵红色加深 正 减小
⑶不变 不
28、(8分)x+y>z 逆向 固态或液态 放热
29、(8分)⑴大于(2分)(2)放热(2分) 3)大于(2分)(4)增大 不(各1分)
30、(10分)(1) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=![]()
![]()
(2)设CO的转化浓度为x CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为 mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2 – x 6 – x x x
K =![]() ,x = 1.5 mol/L
,x = 1.5 mol/L ![]()
(3) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a – c b – c c c
①![]() ,②a = b,则a = 2c
,②a = b,则a = 2c
三、计算题(6分)
31、(6分)(1)56% 70%(3分)(2)![]() 或
或![]() (3分)
(3分)