高二化学试卷
说明:1.本试卷共8页,试卷满分150分,考试用时120分钟。
2.请同学们把答案写在答题卷上,考试结束只交答题卷。
第I卷 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ / mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ / mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ / mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ / mol
2.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
3.下列说法正确的是( )
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C. 燃烧热或中和热是反应热的种类之一
|
4.下列各组离子一定能大量共存的是( )
A.含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
5.下列反应离子方程式正确的是( )
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- = AlO2- + 2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O- → 2C6H5OH + CO32-
C.向小苏打溶液中加入醋酸溶液:HCO3- + H+ = CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2= Fe3+ +Br2 + 4Cl -
6.能正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
7.在pH=1的溶液中,可以大量共存的离子是( )
A.K+、Na+、SO42—、S2O32— B.NH4+、Mg2+、SO42—、Cl—
C.Na+、K+、HCO3—、Cl— D.K+、Na+、AlO2—、NO3—
8.能用离子方程式H++OH-=H2O表示的反应是( )
A.稀醋酸和稀氨水反应 B.稀硫酸和烧碱溶液反应
C.稀盐酸和氢氧化铜反应 D.稀硫酸和氢氧化钡溶液反应
9.从海水中可以提取溴,主要反应为:2Br—+Cl2=2Cl—+Br2,下列说法正确的是( )
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
10.下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应,有氢气产生:Mg + 2H++ 2Cl— == MgCl2 + H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生;Ba2+ + SO42— == BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出;Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色;Fe + Fe3+ == 2Fe2+
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
![]() 11.已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为
11.已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为
1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
![]() 12.对于反应2SO2+O2
12.对于反应2SO2+O2![]() 2SO3,下列判断正确的是( )
2SO3,下列判断正确的是( )
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
13.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
2A(气)+B(气)=2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B. ①④ C. ②③ D. ③④
14.反应:L(固)+aG(气)![]() bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
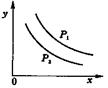 A.上述反应是放热反应
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a<b
15.压强变化不会使下列化学反应的平衡发生移动的是( )
|
C.2SO2(g)+O2(g) ![]() 2SO3(g) D.C(s)+ CO2(g)
2SO3(g) D.C(s)+ CO2(g) ![]() 2CO(g)
2CO(g)
16.放热反应CO(g)+H2O(g)
![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A.K2 和K1的单位均为mol/L B.K2 <K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
17.对已达化学平衡的下列反应
2X(g)+Y(g)![]() 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
18.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g) 此反应达到平衡的标志是( )
2Z(g) 此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1mol X同时生成0.2mol Z
19.在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.lmol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
20.可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
第II卷 非选择题(共80分)
三、(本题包括5小题,共34分)
21.(6分)
在稀氨水中存在平衡:NH3+H2O![]() NH
NH![]() +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH![]() 、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。
⑴通入适量HCl气体时,c(NH3) ,c(H+) 。
⑵加入少量NaOH固体时,c(NH![]() )
,c(OH-)
。
)
,c(OH-)
。
⑶加入NH4Cl晶体时,c(NH![]() )
,c(OH-)
。
)
,c(OH-)
。
22.(10分)
在a、b两支试管中,分别装上形态相同、质量相等的一颗锌粒,然后向两支试管中分别加入相同物质的量、相同体积的稀盐酸和稀醋酸。填写下列空白:
⑴a、b两支试管中的现象:相同点是 ;不同点是 ;原因是 。
⑵a、b两支试管中生成气体的体积开始时是a 于b,反应完毕后生成气体的总体积是a b,原因是
。
23.(8分)
某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中c(OH—)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
24.(4分)
室温时,将pH=5的H2SO4稀释10倍,则c(H+)∶c(SO42—)= ,将稀释后的溶液再稀释1000倍,则c(H+)∶ c(SO42—)= 。
25.(6分)
某温度下,重水(D2O)的离子积KW=1×10-12,若用pH一样的定义来规定pD,则pD=-lgc(D+)。
|
⑴纯重水的pD=__________;
⑵1L溶有0.01 mol NaOD的D2O溶液,其pD=_________。
⑶100 mL 0.1 mol·L-1的D2SO4的D2O溶液与100 mL 0.4 mol·L-1的KOD和D2O溶液混合后,pD= 。
四、(本题包括3小题,共19分)
26.(6分)
物质的量浓度相同的 ① 氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵五种溶液中,C(NH4+)大小的顺序是__________________ ,溶液pH大小的顺序是__________________ 。(用序号填空)
27.(3分)
在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L 和Bmol/L ,则A与B的关系是 。
28.(10分)
某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
回答下列问题:
⑴Na2A溶液显________ (填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)______________________________________________ 。
⑵若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______ 0.11mol/L(填“>”、“=”、“<”)。理由是______________________________________
_____________________________________________________________ 。
⑶NaHA溶液中各离子浓度由大到小的顺序是______________________ 。
五、(本题包括3小题,共14分)
29.(4分)
热化学方程式2H2(g)+ O2(g)=2H2O(l);△H=-484kJ/mol表示的意义为:
。
30.(4分)
已知在298K,101kPa时,1gH2燃烧生成液态水放出142.9kJ的热量,则2mol H2燃烧生成液态水的热化学方程式为: 。
31.(6分)
298K时,合成氨反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)
ΔH=-92.4KJ/mol。在该温度下,取1molN2和3molH2放在密闭容器,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是
2NH3(g)
ΔH=-92.4KJ/mol。在该温度下,取1molN2和3molH2放在密闭容器,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是
。
六、(本题包括2小题,共13分)
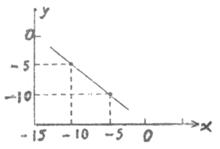 32.(8分)
32.(8分)
某温度下的水溶液中,C (H+) = 10x mol/L,C (OH—) = 10y mol/L,x和y的关系如图所示。计算:
⑴该温度下水的离子积为多少?
⑵该温度下,0.01mol/L的NaOH溶液的pH为多少?
|
33.(5分)
已知AgCl的Ksp=1.80×10-10,将0.001 mol.L-1NaCl和0.001 mol.L-1AgNO3溶液等体积混合,通过计算判断是否有AgCl沉淀生成?