高二化学总复习
化学反应与能量变化 测试题
一.选择题(每小题只有一个选项符合题意)
1.为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
2.下列描述中,不符合生产实际的是
A、电解熔融的氧化铝制取金属铝,用铁作阳极
B、电解法精炼粗铜,用纯铜作阴极
C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D、在镀件上电镀锌,用锌作阳极
3.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O由此可知,该电池充电时的阴极材料是
A、Cd(OH)2 B、Ni(OH)2 C、Cd D、NiOOH
4.把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A、1︰2︰3 B、3︰2︰1 C、6︰3︰1 D、6︰3︰2
|
![]() A、2SO2 + O2 2SO3 △H= -196.6kJ/mol
A、2SO2 + O2 2SO3 △H= -196.6kJ/mol
B、N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
C、C(s)+O2(g)=CO2(g) △H= +393.5kJ/mol
D、H2O(l)== H2(g)↑+1/2O2(g)↑ △H= +285.8kJ/mol
6.下列各图所表示的反应是吸热反应的是
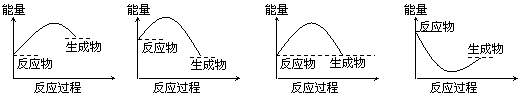 |
A B C D
7.已知热化学方程式:SO2(g)+ O2(g) ![]() SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
A、196.64kJ B、196.64kJ/mol C、<196.64kJ D、>196.64kJ
8.已知:P4(s、白磷)+5O2(g)= P4O10(s) △H =-2983.2 kJ/mol
4P(s、红磷)+5O2(g)= P4O10(s) △H =-2954 kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是
A、吸收29.2kJ热量 B、放出29.2kJ热量
C、放出7.3kJ热量 D、吸收7.3kJ热量
二.选择题(每小题有一个或两个选项符合题意)
9.我国燃煤锅炉采用沸腾炉(注:通过空气流吹沸使煤粉在炉膛内呈“沸腾状”燃烧)的逐渐增多,采用沸腾炉的好处是
A、增大煤燃烧时的燃烧热并形成清洁能源
B、减少煤中杂质气体(如SO2)的形成
C、提高煤炭的热效率,并减少CO的排放
D、使燃料燃烧充分,从而提高燃料的利用率
10.下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
11.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
A、NaOH B、H2SO4 C、AgNO3 D、Na2SO4
12.已知 (1)H2(g)+1/2O2(g)=H2O(g) △H1=a kJ/mol
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ/mol
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ/mol
下列关系式中正确的是
A、a<c<0 B、b>d>0 C、2a=b<0 D、2c=d>0
13.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A、放电时,LiMn2O4发生还原反应
B、放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C、充电时,LiMn2O4发生氧化反应
D、充电时,阳极反应为:Li++e-==Li
14.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间后(假设电解时温度不变且用惰性电极),下列说法正确的是
A、当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B、电池的正极反应式为:O2 + 2H2O + 4e— = 4OH—
C、电解后c(Na2CO3)不变,且溶液中有晶体析出
D、电池中c(KOH)不变;电解池中溶液pH变大
15.将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是(D)
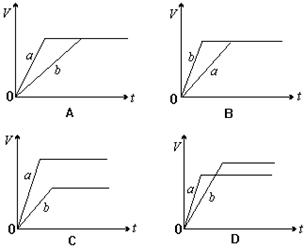
![]() 16.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH— 2CO32— + 6H2O,则下列说法错误的是
16.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH— 2CO32— + 6H2O,则下列说法错误的是
A、放电时CH3OH参与反应的电极为正极
B、充电时电解质溶液的pH逐渐增大
C、放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O
D、充电时每生成1 mol CH3OH转移6 mol电子
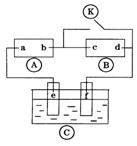 17.下图
17.下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽。接通电路后发现
为电镀槽。接通电路后发现![]() 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通![]() 后,使c、d两点短路。下列叙述正确的是
后,使c、d两点短路。下列叙述正确的是
A、a为直流电源的负极
B、c极发生的反应为2H++2e-=H2↑
C、f电极为锌板
D、e极发生氧化反应
18.某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是
A、阴极产物为H2 B、阳极先析出Cl2,后析出O2
C、电解液的pH不断增大,最终大于7 D、整个电解的过程实质是电解水
三、填空题
19.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
20.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
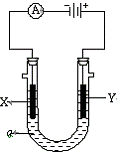 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 ,
在X极附近观察到的现象是 。
② Y电极上的电极反应式为 , 检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
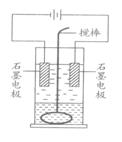 21.在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体
,装置如图所示。接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。回答:
21.在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体
,装置如图所示。接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。回答:
(1)阳极上的电极反应式为 ;
阴极上的电极反应式为 。
(2)原上层液体是 ,原下层液体是 。
(3)搅拌后两层液体颜色发生变化的原因是
。
(4)要检验上层液体中含有的金属离子,其方法是 ;
现象是 。
22.已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________ 。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,正极 。(若不能后面两空不填)
③若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液。 _________________________________ 。
④有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性。 。
23.工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,③过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极_______________________,阴极____________________。
(2)写出Cr2O72-转变成Cr3+的离子反应______________________________________。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
______________________________________________________________________。
(4)能否将Fe电极改成石墨电极?为什么?
________________________________________________________________________ 。
24.某同学查资料得知α-AgI是一种固体导体,导电率很高。他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验。
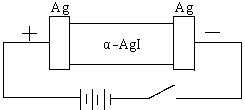
![]() 已知铅蓄电池总反应:
已知铅蓄电池总反应:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)该电解池的阳极电极方程式:
;
铅蓄电池的正极电极方程式:
。
(2)若Ag+导电,α-AgI本身质量将 。(填“不变”、“变大”、或“变小”,下同。)
若I-导电,阳极附近的α-AgI晶体密度将会 。
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 __________g。
四、计算题
25.已知:(1)Fe2O3(s) + 3CO(g) == 2Fe(s) + 3CO2(g) △H1= -26.7kJ/mol
(2)3Fe2O3(s) + CO(g) == 2Fe3O4(s) + CO2(g) △H2= -50.75kJ/mol
(3) Fe3O4(s) + CO(g) == 3FeO(s) + CO2(g) △H3= -36.5kJ/mol
计算反应:2FeO(s) + 2CO(g) == 2Fe(s) + 2CO2(g)的△H 。
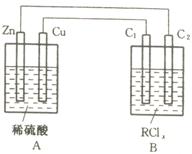 26.某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
26.某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
参考答案:一、二选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D | A | A | D | B | A | C | D | CD |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | A | C | AB | BC | C | A | BD | D |
三、
19、(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H= -641.75kJ/mol
(2)408.875
(3)产物无污染
20、(1)①2H++2e-=H2↑ 有气泡产生,溶液变红
②2Cl--2e-=Cl2↑ 湿润的淀粉碘化钾试纸放在管口,变蓝。
(2)①纯铜 Cu2++2e-=Cu ②粗铜Cu- 2e-= Cu2+
21、(1)2I--2e-=I2 2H++2e-=H2↑
(2)KI或NaI CCl4
(3)CCl4萃取了碘水中的碘
(4)焰色反应实验 火焰呈黄色为钠离子;透过蓝色钴玻璃观察火焰呈紫色为钾离子
22、①铝、铜与电解质溶液组成原电池,铝线被腐蚀
②Cu- 2e-= Cu2+ 2Fe3++2e-=2Fe2+
③电解池 铜作阳极石墨作阴极用稀盐酸作电解质溶液
④将M、N用导线相连插入盐酸中,金属上产生气泡的为不活泼金属
23、(1)Fe-2e-=2Fe2+ 2H++2e-=H2↑
(2)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
(3)电解过程中H+逐渐被消耗,溶液酸性逐渐减弱,碱性逐渐增强,反应生成的Fe3+、Cr3+就变成Cr(OH)3、Fe(OH)3沉淀。
(4)不能,若改成石墨电极,不能产生还原剂Fe2+,无法除去Cr2O72-
24、(1)Ag++e-=Ag PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)不变 增大
(3)108
25、△H= 14.55kJ/mol
26、64