高二化学会考复习化学用语及物质的量测试
班级 姓名 学号
一.选择题(共60分,每小题只有一个选项)
1.若标准状况下2L氧气中有n个分子,则阿伏加德罗常数为
A、n/22.4 B、n/32 C、22.4n D、11.2n
2. 下列叙述正确的是
A. H+的摩尔质量是1 g B. H+的摩尔质量是1 g/mol
C. H+的摩尔质量是1 D. H+的摩尔质量是1 mol
3.等质量的下列物质中,含分子数最少的是
A.H2O B.CO2 C.NH3 D.SO2
4. 将1molNa2SO4溶于水配成500 ml溶液,则Na2SO4溶液的物质的量浓度为(单位为mol/L)
A. 2 B. 1 C. 0.5 D. 0.25
5.下列说法正确的是(N表示阿伏加德罗常数〕
A.28g氮气所含有的原子数目为N
B.4g金属钙变成钙离子时失去的电子数目为O.1N
C.lmol甲烷的质量与N个甲烷分子的质量之和相等
D. 标准状况下,22.4水所含的分子数为N
6.已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g·cm-3,若将上述两溶液等体积
混合,所得氨水溶液的质量分数是
A. 等于15% B.大于15% C.小于15% D.无法估算
7.下列化学名词正确的是
A、笨酚 B、烧碱 C、乙酸乙脂 D、加层反应
8.有关化学用语正确的是
A、乙烯的最简式C2H4 B、乙醇的结构简式C2H6O
C、四氯化碳的电子式\S\UP8(.. D、臭氧的分子式O3
9.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A、N4是N2的同素异形体 B、N4是N2的同分异构体
C、相同质量的N4和N2所含原子个数比为1:2 D、N4的摩尔质量是56g
10.以下命题,违背化学变化规律的是
A、石墨制成金刚石 B、煤加氢变成人造石油
C、水变成汽油 D、干冰转化成原子晶体
11.常温下,在密闭容器里分别充入各0.1mol两种气体,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是
A.H2和O2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
12.在一个密闭容器中盛有11gX气体(X的摩尔质量为44g·mol-1)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约为
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
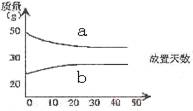 13.18.4mol/L的浓硫酸和12mol/L的浓盐酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是
13.18.4mol/L的浓硫酸和12mol/L的浓盐酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是
A、a升华、b冷凝 B、a挥发、b吸水
C、a蒸发、b潮解 D、a冷凝、b吸水
14. 设N表示阿伏加德罗常数的值,下列说法不正
确的是
A.N个氧原子的质量在数值上和氧的原子量相等
B.N个氧分子和N个氢分子的质量比等于16∶1
C.28g氮气所含的原子数目为N
D.在标准状况下,0.5N个氯气分子所占体积约是11.2L
15.下列溶液中的[Cl-]与50ml 1mol/L 氯化铝溶液中的[Cl-]相等的是
A.150mL1mol·L-1氯化钠溶液 B.75mL2mol·L-1氯化铵溶液
C.150mL3mol·L-1氯化钾溶液 D.75mL1mol·L-1氯化镁溶液
16.质量相等的两份气体样品,一份是CO,另一份是![]() ,这两份气体样品中,CO与
,这两份气体样品中,CO与![]() 所含氧原子的原子个数之比是
所含氧原子的原子个数之比是
A.1∶2 B.1∶4 C.11∶14 D.11∶28
17.有同温、同压、同体积的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO和CO2所含氧原子的个数比是
A.1:2 B.2:1 C.1:1 D.1:4
18.b g某金属与足量的稀硫酸反应,生成该金属的三价正盐和a g氢气。则该金属的相对原子质量为
A.2b/a B.3b/2a C.3b/a D.a/3b
19.在无土栽培中,需配制一定量含50 mol NH4Cl、16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A.2、64、24 B.64、2、24 C.32、50、12 D.16、50、24
20.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A.1 B.2 C.3 D.4
21.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.密度 C.质量 D.质子数
22.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A.10% B.15% C.20% D.25%
23.在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a. CO2,100 mL;b. O2,200 mL;c. N2,400 mL;d. CH4,600 mL。则4个容器中气体的质量由大到小的顺序是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
24.下列指定微粒的个数比为2:1的是
A. Be2+离子中的质子和电子 B.21H 原子中的中子和质子
C.NaHCO3 晶体中的阳阴离子 D. Na2O2固体中的阴离子和阳离子
25.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
26.下列实验操作中,错误的是
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B.配制0.1mol/L的NaCl溶液时,用到的仪器有容量瓶;托盘天平和玻璃棒等
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
27.已知Q与R的摩尔质量之比为9:22,在反应X+2Y=2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为
A.46 : 9 B.32 : 9 C.23 : 9 D.16 : 9
28.在物质的量相同的不同的物质中,必定相同的是:
A.质量 B.分子个数 C.标准状况下体积 D.摩尔质量
29.由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为
A.198个 B.199个 C.200个 D.201个
30.一定质量的Mg,Al的混合物与足量稀H2SO4反应,生成H2 11.2L(标准状况),原混合物的质量可能是
A 9g B 10g C 12g D 24g
二、填空题 (每空1分,共分)
31.34 g NH3中约含有 个NH3分子,在标准状况下约占__________L。
将其全部溶于水中得到0.5 L溶液,物质的量浓度为 ___________mol·L—1。
32.1 molN2与1 molCO2相比,所含分子数之比为____________,原子数之比为_________;
物质的量相同的氮气和二氧化碳气体在相同条件下的体积之比为___________.
33.实验室制取Cl2的反应为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,若制得标准状况下的Cl2 4.48 L,则被氧化的HCl的物质的量为________mol,转移电子的物质的量为________mol.
MnCl2+Cl2↑+2H2O,若制得标准状况下的Cl2 4.48 L,则被氧化的HCl的物质的量为________mol,转移电子的物质的量为________mol.
三、简答题:
34.氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与
酸反应),则试样中氢氧化钡的物质的量为 mol。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,则
Ba(OH)2·nH2O中的n值是 。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
35.要配制浓度约2mol/LNaOH溶液100mL,下面操作正确的是 。
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
36.已知在由硫酸铝、硫酸钾、明矾三种物质组成的混合液中,SO42-离子浓度为0.200mol/L。当加入等体积的0.200mol·L-1的KOH溶液后(设混合后的体积变化忽略不计),生成的白色沉淀恰好溶解。则反应后的混合液中K+离子浓度为 mol·L-1
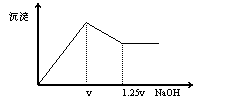 37.有MgCl2、Al2(SO4)3的混合溶液,向其
37.有MgCl2、Al2(SO4)3的混合溶液,向其
中不断加入NaOH溶液,得到的沉淀量与
加入的NaOH溶液的关系如图所示,
则溶液中[Mg2+]与[Al3+]之比为 。
38.在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中
V(CO)︰V(H2)= 。
(3)若剩余气体的体积为aL,则a的取值范围是 。
四、计算题
39.标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol·L-1、密度为0.915 g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00 g/cm3计)
40.物质的量浓度为15.8mol/L的氨水(密度为0.9g/mL),求它含氨的质量分数是多
少?
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | B | D | A | C | C | B | D | A | C | A | C | B | C | C |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| C | A | C | B | A | A | D | C | A | B | D | D | B | B | B |
31 1.2x1024 44.8 4
32 1:1 2:3 1:1
33 0.4 0.4
34 (1)0.01mol (2)8 (3)90%
35 A D
36 0.225
37 1:2
38 (1) 5 5 (2) (a-10)/(20-a ) (3) 10<a<20
39 378
40 30%