高二化学上期第三次月考试题
本试题分两部分,第一部分为选择题,第二部分为非选择题;共24小题。
可能用到的相对原子量:H 1 Al 27 N 14 Mg 24 Na 23 S 32 Cl 35.5 Fe 56 Cu 64
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.下列气体既可以用浓硫酸干燥,又能用P2O5或碱石灰干燥的是 ( )
A. SO2 B.Cl2 C.NH3 D.N2
2.下列反应的化学方程式中,属于水解反应的是( )
![]() A. HCO3—+H2O H2CO3+OH—
A. HCO3—+H2O H2CO3+OH—![]() B.HCO3—+H2O H3O++CO32—
B.HCO3—+H2O H3O++CO32—
C.HCO3—+H3O+ = H2O+CO2↑ D. HCO3—+OH— = CO32—+H2O
![]() 3.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
3.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A. V(O2)=0.01mol.L-1.s-1 B. V(NO)=0.008mol.L-1.s-1
C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1
4.下列说法中正确的是 ( )
A.氮元素是活泼的非金属元素,因此其单质的化学性质也很活泼
B.二氧化氮溶于水生成硝酸,因此二氧化氮是硝酸的酸酐
C.雷雨时,可增加土壤中硝酸盐类氮肥的变化属于氮的固定
D.氨气可作焊接金属的保护气
5、 现有浓度为1 mol/L的五种溶液:①HCI,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是 ( )
A.④>③>①=⑤>② B.①=②>③>④>⑤
C.②>①>③>④>⑤ D.④>③>①>⑤>②
6.砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用—定剂量的氧化剂解毒。下列有关叙述正确的是 ( )
A.砷元素在化合物中的常见价态有+3、+5、+7 B.砷酸的酸性强于磷酸
C.砷化氢(AsH3)比NH3稳定
D.砷的+3价化合物的毒性强于+5价化合物
7.某酸HA的下列性质中,可以证明它是弱电解质的是 ( )
A. HA溶液的导电能力比盐酸弱
B. 0.1 mol/LHA溶液的pH约为3
C.10ml 1mol/L HA能于等体积等浓度的NaOH溶液恰好反应
D. HA能溶与水
8.20℃时,H2S的饱和溶液,浓度约为0.1mol/L,其电离方程式为:第一步 H2S ![]()
H+ + HS─;第二步 HS─ ![]() H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,可采用的措施是①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2; ④加入适量硫酸铜固体;⑤加入少量盐酸
(
)
H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,可采用的措施是①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2; ④加入适量硫酸铜固体;⑤加入少量盐酸
(
)
A.①③⑤ B.②④⑤ C.②③ D.③④⑤
9、在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
( )
A、平衡向正反应方向移动了 B、平衡向逆反应方向移动了
C、物质B的质量分数增加了 D、a<b
10、某同学的实验报告中有如下数据,其中数据合理的是 ( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
11.将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入
4mol·L-1的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是 ( )
A.125mL B.200mL C.250mL D.560mL
12.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是: ( )
A.Cl-、NO3-、Ca2+、Na+ B.Na+、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
13.6.4克铜与一定量的浓硝酸恰好完全反应,生成的气体被饱和氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为 ( )
A.0.2mol B.0.3mol C.0.1mol D.0.5mol
![]() 14.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是: ( )
14.在一定温度下,A2(g)+B2(g) 2AB(g)达到平衡的标志是: ( )
A.单位时间内减少n mol A2,同时生成2n mol AB
B.单位时间内生成n mol B2,同时生成n mol AB
C.单位时间内生成 2xmol AB, 同时生成xmol A2
D.容器内各组成成分的物质的量之和不随时间变化而变化
15. 在10 mL 0.1mol/L的NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.C(Na+)=c(CH3COO-)+c(CH3COOH) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
16.在室温下,等体积的酸和碱溶液混合后,pH一定小于7的是 ( )
A.pH=3的HNO3与pH=11的KOH溶液
B.pH=3的盐酸与pH=11的氨水
C.pH=3的硫酸与pH=11的NaOH溶液
D.pH=3的醋酸与pH=11的Ba(OH)2溶液
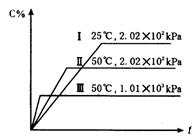 17.在一密闭容器中进行如下反应:A(g)+B(g)
17.在一密闭容器中进行如下反应:A(g)+B(g) ![]() 2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是 ( )
2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是 ( )
A 正反应为吸热反应,D是固体;
B 正反应为吸热反应,D是气体;
C 正反应为放热反应,D是固体或液体;
D 正反应为放热反应,D是气体;
18.一定条件下,可逆反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,
则下列判断不合理的是 ( )
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
 龙台中学2006-2007学年度上期高二化学第三次月考试题
龙台中学2006-2007学年度上期高二化学第三次月考试题
一.选择题答题卡(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 |
二.填空题
19.(4分)久置的浓硝酸发黄是因为_______________________________________;液氨常用做制冷剂,其原因是______________ ;实验室制氨气的化学反应方程式是_____________________,用_____________________________(操作)检验NH3是否充满集气瓶。
20.(6分)在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发
生如下反应:X(g)+Y(g)![]() 2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,若降
2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,若降
低温度,化学反应速率 ,Z的浓度 。(填“增大”、“减小”或“不变”)。
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
|
|
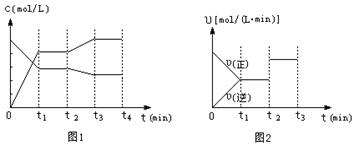
由图1判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
21、(8分)常温下,PH=2的高碘酸(HIO4)溶液与PH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与PH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
⑴高碘酸是 (填“强酸或弱酸”),理由是 ;
⑵0.01mol/L的碘酸(HIO3)溶液与PH=12的NaOH溶液等体积混合所得溶液中IO3—与Na+的浓度关系是 (填“大于、小于或等于”)。
⑶已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,此反应中的还原剂是 ,
(写化学式),该反应的离子方程为 。
22.(10分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)

(1)无色溶液F中,一定含有的溶质的化学式为______
(2)写出白色胶状沉淀C转化为无色溶液E的化学方程式 ________________________。
(3)A和B的混合物溶于水发生反应的离子方程式 ________
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式_________________________________________________________。
23.(8分)(1)在25℃条件下将pH=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号)__________;
A.3 B.5 C.2~3之间 D.3~5之间
(2)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是_______ ;
(3)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入 试剂;
(4)常温下,0.1mol·L-1的醋酸和PH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体体积前者比后者 (填“大” ,“小” 或“等”)。
三、实验题
24、(10分)阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
 (1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
试题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | D | C | A | D | B | C | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | C | B | C | C | C | D | D | C |
![]() 19、浓硝酸见光或受分解产生的NO2溶于硝酸中的缘故;氨气容易液化,且液氨汽化时要吸收大量的热量;2NH4Cl
+ Ca(OH)2 2NH3↑ + CaCl2 +2H2O;湿润的红色石蕊试纸靠近集气瓶口(或用玻璃棒蘸取浓盐酸靠近集气瓶口)
19、浓硝酸见光或受分解产生的NO2溶于硝酸中的缘故;氨气容易液化,且液氨汽化时要吸收大量的热量;2NH4Cl
+ Ca(OH)2 2NH3↑ + CaCl2 +2H2O;湿润的红色石蕊试纸靠近集气瓶口(或用玻璃棒蘸取浓盐酸靠近集气瓶口)
20.减小,增大 2分
t2 时对平衡体系降温 2分 b d (有错不给分2)
21、⑴弱酸;PH=2的高碘酸电离出的c(H+)和PH=12NaOH溶液电离出的c(OH—)相等,且两者体积相等,但溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸。(其他合理答案也给分,)3分
⑵等于)2分
⑶MnSO4(1分);2Mn2+ + 5HIO4 + 3H2O== 2MnO4— + 5IO3—+ 11H+(每空2分)
22.(1)Na2CO3(2分) (2)Al(OH)3+NaOH=NaAlO2+2H2O (2分)
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑ (2分)
(4)产生白色沉淀 HCO3- +AlO2-+ H2O = Al(OH)3↓+ CO32-
23、(1)D (2分) (2)醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小(2分)
减小(2分)
(3)醋酸钠 (2分)(4)小(2分)
24、(10分)(1)①ECDBAGF;②酚酞;③无色变为浅红色(或粉红色)且半分钟不褪去。
(2)偏大
(3)100.00mL容量瓶
(4)0.1mol/L;溶液浓度越稀,误差就越小
(5)乙
(6)偏小
(7)4.20mol/L