高二化学专题检测试题
一、选择题(每小题只有一个选项符合题意)
1.下列状态下,不能导电的电解质是
A.液态氯化氢 B.熔融食盐 C.胆矾晶体 D.氯水
2.用pH试纸测定某氨基酸溶液的pH,如果将pH试纸润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=8。则此氨基酸溶液的实际pH
A.大于8 B.小于8 C.等于8 D.小于7
3.NH4+离子浓度相同的下列各物质的溶液中,物质的量浓度最大的是
A.NH4 Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3
4.pH=5的H2SO4溶液稀释500倍后,溶液中c(H+):c(SO42-)约为
A.1:2 B.1:5 C.1:10 D.10:1
5.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均减小
B.温度下降10ºC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
6.常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2mol•L-1的盐酸与0.1mol•L-1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是
A.a>b=c B.a>c>b C.c>b>a D.b>c>a
7.已知Ksp[Mg(OH)2]=5.61×10-12,向Mg(OH)2饱和溶液中加入MgCl2,使Mg2+浓度为0.010mol·L-1,则该溶液的pH为
A.4.75 B.9.23 C.9.37 D.10.15
8.t℃时,水的离子积为 Kww,该温度下将a mol·L-1的一元酸HA与 b mol·L-1的一元碱 BOH等体积混合,要使混合液呈中性,必要的条件是
A.混合液的pH=7 B.混合液中,c(H+)=
C.a=b D.混合液中,c(B+)=c(A-)+c(OH-)
9.相同温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.c(H+) C.c(OH-) D.c(CH3COOH)
10.25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后
所得溶液呈中性 。若x=1/3 y ,则x值为
A.2 B.3 C.4 D.5
二、选择题(每小题有一个或两个选项符合题意)
11.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
A.氯化铝溶液 B.碳酸钠溶液 C.硫酸镁溶液 D.高锰酸钾溶液
12.将0.1mol下列物质置于0.1L水中充分搅拌后,溶液中阴离子数最多的是
A.KCl B.Mg(OH)2 C.Na2S D.MgSO4
13.在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是
A.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
B.c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C.c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-)
D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
14.用物质的量都是0.1mol的CH3COOH和CH3COONa混合后配成1L溶液,已知溶液中的c(CH3COO-)>c(Na+),则下列关系正确的是
A.c(H+)<c(OH-) B.c(CH3COO-)+c(OH-)=0.1mol•L-1
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COOH)+c(CH3COO-)=0.2mol•L-1
15.下列有关分步沉淀的叙述,不正确的是
A.溶解度小的物质先沉淀 B.浓度积先达到Ksp的先沉淀
C.组成类型相同时,溶度积小的物质先沉淀 D.被沉淀离子浓度大的先沉淀
16.某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是
A.该温度下,0.0l mol/L醋酸溶液的pH=4
B.该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10
C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7
D.该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7
17.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)> c(A-)> c(H+)> c(OH-)
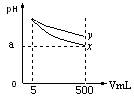 18.pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
18.pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
19.在常温下100mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7,则对反应后溶液的叙述正确的是
A.V(混合液)≥200mL B.V(混合液)≤200mL
C.c(H+)= c(OH-)< c(K+)< c(A-) D.c(A-)= c(K+)
20.已知HF的酸性比HCN强,现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是
A.溶液pH:NaF>NaCN B. n1>n2 C. n1<n2 D. c(F-)>c(CN-)
三、实验题
21.以标准的盐酸溶液滴定未知的氢氧化钠为例,判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)
(1)读数:滴定前俯视或滴定后仰视
(2)未用标准液润洗滴定管
(3)用待测液润洗锥形瓶
(4)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失
(5)不小心将标准液滴在锥形瓶外面
(6)滴定接近终点时,用少量蒸馏水冲洗瓶内壁
22.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
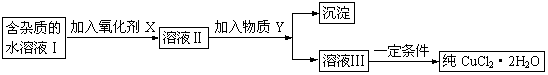
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________。
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)除去Fe3+的有关离子方程式是(物质Y在(2)中选择合适的选项):
_______________________________________________。
(4)加入氧化剂的目的是________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)________________________________。
四、填空题
23.相同条件,等物质的量浓度的下列八种溶液:①Na2CO3 ②NaClO ③CH3COONa ④Na2SO4 ⑤NaHCO3 ⑥NaOH ⑦(NH4)2SO4 ⑧NaHSO等溶液,pH值由大到小的顺序为: 。
24.我们知道空气中含有N2、O2、CO2、H2S等气体。分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到显现浅红色且半分钟内不褪色为终点。约半分钟后导致褪色的原因:__________ __________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2 = S4O62-+2I-),到蓝色恰好褪去为终点,约5min后溶液又显色的原因:_____ _。
(3)以紫色KMnO4为标准溶液滴定还原剂,在消耗完还原剂后,再多加0.5~1滴KMnO4溶液后呈现的浅红色在半分钟内不褪色为终点。约半分钟后浅红色褪色的可能原因:__________________ 。
25.泡沫灭火器是常用的灭火器,其结构分内筒和外筒。内筒为塑料筒,外筒为钢筒。使用的药品为硫酸铝溶液和碳酸氢钠溶液,分盛在上述两筒中。使用时将灭火器倒置就会产生大量的二氧化碳和氢氧化铝等一起以泡沫的形式喷出。
(1)内筒所盛的药品是 ,为什么不能盛放在外筒中? 。
(2)产生泡沫的原理是什么?(用离子方程式表示) 。
(3)有人用碳酸氢钠晶体代替其溶液,你认为是否合理?为什么?
。
(4)有人用碳酸钠溶液代替碳酸氢钠溶液,你认为是否合理?为什么?
。
26.(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+)> c (CN-)(用“>”、“<”或“=”填空)。
①溶液中c (OH-) c (H +); ②c (HCN) c (CN)。
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大。你的选择是 。
(3)pH值相同的 ①HCl溶液 ②H2SO4溶液 ③ CH3COOH溶液各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是 。
③反应开始时,反应速率 。(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(4)某温度下,纯水中c (H+)=2.0×10-7 mol/L,则此时c (OH-) = mol/L。相同条件下,测得① NaHCO3溶液 ② CH3COONa溶液 ③ NaClO溶液三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
五、计算题
27.25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va=Vb和a=0.5b,请填写下列空白:
(1)a的值可否等于3(填“可”或“否”) ,其理由是 。
(2)a的值可否等于5(填“可”或“否”) ,其理由是 。
(3)a的取值范围 。
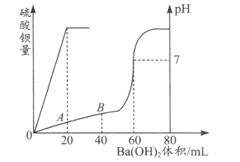
28.有盐酸和硫酸的混合液20mL,加入0.05mol·L-1的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液的pH发生如图所示的变化:
(1)求原混合液中硫酸和盐酸的物质的量浓度各是多少?
(2)求在A点时的pH是多少?
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | B | D | A | B | C | B | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BC | C | BD | D | A | B | A | C | BD | BD |
21.(1)偏大(2)偏大(3)偏大(4)偏大(5)偏大(6)无影响
22.(1)C (2)B (3)Fe3++3H2O![]() Fe(OH)3+3H+ CuO+2H+=Cu2++H2O
Fe(OH)3+3H+ CuO+2H+=Cu2++H2O
(4)将Fe3+氧化成Fe2+,便于生成沉淀而与Cu2+分离
(5)不能 应在HCl气流中蒸发
23.NaOH、NaClO、Na2CO3、NaHCO3、CH3COONa、Na2SO4、(NH4)2SO4、NaHSO4
24.(1)空气中存在CO2,H2S;CO2+OH-=HCO3-,H2S+OH-=HS-+H2O
(2)空气中存在O2; O2+4I-+4H+=2H2O+I2
(3)空气中存在H2S;5H2S十2MnO4-+6H+=2Mn2++5S↓+8H2O
25.(1)硫酸铝溶液 铝离子水解溶液显酸性会腐蚀钢筒,所以不能盛放在钢筒中
(2)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)不合理 由于碳酸氢钠在水中溶解度不大,水解时产生的Al(OH)3会覆盖在晶体表面,使反应停止
(4)不合理 与碳酸氢钠相比,产生相同量的CO2,碳酸钠耗酸多且产生CO2的速率慢。在酸量一定的条件下,用碳酸钠溶液代替碳酸氢钠溶液会使产生的CO2很少,甚至不能喷出泡沫
26.(1)①>
②>
(2)C
(3)① CH3COOH(aq)
② CH3COOH(aq)
③ D
(4)2.0×10-7 mol/L,② ① ③
27.(1)否 若a=3,则b=6,溶液呈酸性与题意不符,故a≠3
(2)否 若a=5,c(H+)a = 10-5mol·L-1,
则b=10,c(OH-)b = 10-4mol·L-1,Va/Vb = c(OH-)b/ c(H+)a>1,不符合题意a≠5
(3)Va/Vb = c(OH-)b/ c(H+)a = 10(a+b-14)<1,所以a+b-14<0,而a=0.5b,
即a<14/3,又pH=b=2a>7,a>7/2,所以7/2<a<14/3。
28.(1)c(H2SO4)=0.05 mol·L-1 c(HCl)=0.2 mol·L-1 (2)1