高二化学会考复习元素化合物练习题
班级 姓名 学号
1.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是
A ![]() B
B ![]() C
C ![]() D
D ![]()
2.下列物质不属于“城市空气质量日报”报道的是
A 二氧化氮 B 二氧化硫 C 可吸入颗粒物 D 二氧化碳
3.为了保护臭氧层,可采取的有效措施是
A.减少二氧化硫的排放量 B.减少含铅废气的排放量
C.减少氟氯代烃的排放量 D.减少二氧化碳的排放量
4.每年的6月5日是世界环境日,在这天各国政府和人们都要进行相关的宣传和整治环境的大行动,环境问题已经成为困扰各国经济发展的重要因素。下列有关环境污染的说法中,不正确的是
A.环境污染主要指大气污染、水源污染、土壤污染、食品污染及噪声等
B.大气污染主要指CO、SO2、NmOn、CmHn及粉尘等
C.大气中CO2浓度增大,是造成酸雨的主要原因
D.从保护环境考虑,未来最理想的燃料是氢气
5.为了减少大气污染,北京市推广使用清洁汽车燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是
A 碳氢化合物 B 一氧化碳 C 氢气 D 醇类
6..上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
7.下列物质中,能用来检验酒精中是否含有水的是
A 生石灰 B 浓硫酸 C 无水硫酸铜 D 金属钠
8.实验室制取下列气体时,只能用排水法收集的是
A.NH3 B.H2 C.SO2 D.NO
9.通常情况下极易溶于水的气体是
A ![]() B
B ![]() C HCl
D
C HCl
D ![]()
10.以下事实,表明硝酸具有强氧化性的是
A.硝酸可以和大理石反应
B.氢氧化铁沉淀可溶于硝酸
C.分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟
D.铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体
11.某无色混合气体,依次通过浓硫酸和过氧化钠时,气体体积不断减少,最后气体变成红棕色,该混合气体的组成是
A.N2、NO、NH3 B.NH3、CO2、N2 C.NH3、CO2、NO D.NH3、N2、NO2
12.气体甲能使湿润的红色石蕊试纸变蓝,气体乙可在空气中产生白雾,当甲与乙相遇时可能生成
A.NH4C1 B.NH4HCO3 C.(NH4)2CO3 D.(NH4)2SO4
13.往下列物质的水溶液中,分别滴加稀硫酸和氯化铝溶液,均有可能产生白色沉淀的是
A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.KOH
14.下列气体既能用浓H2SO4干燥,又能用碱石灰干燥的是
A.Cl2 B.SO2 C.H2 D.NH3
15.下列试剂保存方法或实验方法不正确的是:
A.浓硝酸、硝酸银用棕色试剂瓶盛放,并置于阴凉处
B.用带玻璃塞的磨口玻璃瓶盛氢氧化钠
C.金属钠、钾通常保存在煤油里
D.可用(NH4)2SO4代替NH4Cl与消石灰混合加热制取NH3
16.能使湿润的红色石蕊试纸变蓝的气体是
A.Cl2 B.H2 C.NH3 D.H2S
17.将铁粉投入稀硝酸中,充分反应后还剩余少量铁粉,反应后溶液中含量较多的阳离子是
A、Fe3+ B、Fe2+ C、Fe2+、H+ D、Fe2+、Fe3+
18.下列各组中的离子,能在溶液中大量共存的是
A.Ag+、Na+、Fe2+、Cl-
B.Na+、NO![]() 、Ca2+、Cl-
、Ca2+、Cl-
C.Ba2+、Br-、Na+、SO![]() D.Mg2+、SO
D.Mg2+、SO![]() 、K+、OH-
、K+、OH-
19.下列各组溶液无论是前者滴入后者,还是把后者滴入前者,所得现象相同的是:
A.AlCl3溶液和NaOH溶液 B.AgNO3溶液和氨水
C.NaAlO2溶液和盐酸 D.MgCl2溶液和氨水
20.下列物质中常用于做净水剂;且水溶液呈酸性的是
A.明矾 B.漂白粉 C.双氧水 D.臭氧
21.含氟牙膏具有防龋齿的作用,考虑到氟和氟化物的性质,下列物质适合加在牙膏中的是
A.NaF B.F2 C.HF D.CF2Cl2(氟利昂)
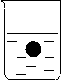 22.如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯
22.如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯
中加入(或通入)下列物质后,小球沉到水底的是
A .HCl B .NH3 C. 浓H2SO4 D .浓HNO3
23.下列物质既能跟盐酸反应,又能跟氢氧化钠溶液反应的是
A. (NH4)2CO3 B.CaCO3 C. Mg(OH)2 D.MgO
24.从节约原料和防止环境污染因素考虑,用铜制取硝酸铜,方法最佳的是:
浓HNO3 稀HNO3
A、 Cu────→Cu(NO3)2 B、Cu────→Cu(NO3)2
Cl2 HNO3 空气 HNO3
C、Cu──→CuCl2──→Cu(NO3)2 D、Cu——→CuO──→Cu(NO3)2
△ △
25.下列有关铁的叙述中正确的是:
A.钢是一种重要的金属材料,它是一种铁碳合金
B.钢比纯铁用途更广,是因为钢不易生锈纯铁更易生锈
C.钢的硬度大于纯铁,熔点也高于纯铁
D.铁在常温和高温下均不能和水蒸气反应生成氢气
26.将一定量的镁和铝分别与足量的盐酸反应,若放出氢气的质量相等,则参加反应的镁和铝的物质的量之比为
A. 1 :1 B.2 :3 C.3:2 D.4 :3
27.等体积的盐酸和氢氧化钠溶液分别与两份足量铝粉反应,在相同条件下产生相同体积的氢气。则盐酸和氢氧化钠溶液物质的量浓度之比为
A.1∶1 B. 2∶1 C.3∶1 D.1 :3
28.下列反应中,有沉淀产生且不会消失的是
A.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量
B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
C.向NaAlO2溶液中逐滴滴入稀硫酸,直至过量
D.将氨水逐滴滴入硝酸银溶液中,直至过量
二、填空题
29.⑴浓硫酸和浓硝酸常用_______ _____等金属制的容器贮存和运输,这是因为常温下,这些金属会在其中发生____________ 现象。
⑵氮元素位于元素周期表中第 周期;第 族,其最高价氧化物对应水化物的化学式为 ,该化合物的酸性比磷酸 (填“强”或“弱”)。磷元素的气态氢化物热稳定性比氨气 (填“强”或“弱”)。NH3的电子式为 ;其分子的空间构型是 。请用方程式表示NH3溶于水是一种弱碱的原因:
。
⑶Fe元素位于元素周期表中第 周期;第 族,Fe与硫反应的方程式为: ; Fe在氯气中燃烧的方程式为: 。
⑷完成下列反应的离子方程式:
①氧化铝和氢氧化钠溶液反应: 。
②用氨水制氢氧化铝: 。
30.分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式。
(1)除去SiO2中混有的少量CaCO3,可选用试剂 。
(2)除去铁粉中混有的少量铝粉,可选用试剂 。
(3)除去乙烷中混有的少量乙烯,可选用试剂 。
31.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置
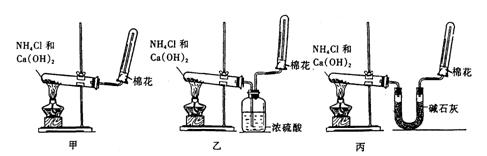
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) 。
(2)写出制取氨气的化学方程式 。
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)
。
三、简答题(共 分)
32.有一无色气体,可能含有HCl、NH3、NO、CO2、O2中的一种或几种。将其通入酸性AgNO3溶液中,有白色沉淀产生;剩余气体与空气接触后呈红棕色。则原气体中一定有____________ ;一定没有____________ ;不能确定的是____________ 。
33.某混合物M,含有MgCl2、Al2O3,和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
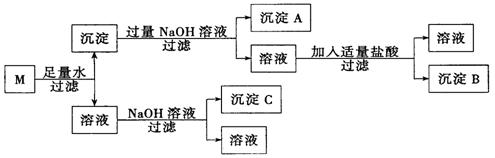
试写出沉淀A、B、C的化学式:A 、B 、C 。
34.某冶炼厂的废渣经处理后含有铁、银、氧化铝三种物质,经加工后可制得多种化工产品。加工的主要流程如下:
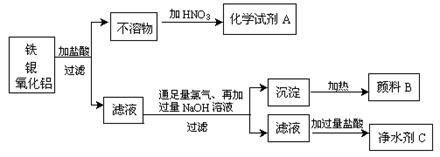 |
试写出产品的化学式:A 、B 、C 。
35.现有NO2和CO2混合气体,有如下的变化:
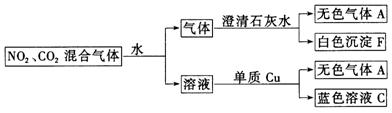
用化学式表示:无色气体A ;蓝色溶液 ;白色沉淀 。
36.某金属X,为了确定其成分,进行一系列实验,实验过程和发生的现象如下图所示:
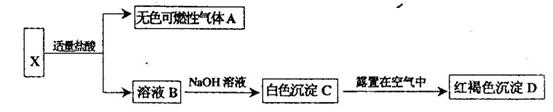 (1)写出金属X的化学式 。
(1)写出金属X的化学式 。
(2)写出溶液B中溶质的化学式 。
(3)写出红褐色沉淀D的化学式 。
37.向aL 1mol/L的![]() 溶液中加入bg铁粉,充分反应后,溶液中
溶液中加入bg铁粉,充分反应后,溶液中![]() 和
和![]() 的物质的量浓度相等。此反应的离子方程式为________________________,a与b之比为_________。
的物质的量浓度相等。此反应的离子方程式为________________________,a与b之比为_________。
四、计算题
38.某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如下表。
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL)(标准状况) | 224 | 336 | 448 | 448 |
请回答:
⑴盐酸的物质的量浓度为____________ ;
⑵甲组合金中镁的质量是____________ ;
⑶若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为__________ 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | D | C | C | A | D | C | D | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | B | C | B | C | B | B | D | A |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | ||
| A | B | A | D | A | C | C | A |
32. 有 HCl NO 无 NH3; O2 不能肯定 CO2
37 1:11.2 38. 1 mol/L 0.096 g 48ml