高二化学会考复习计算题练习
班级 姓名 学号
1.据报道,某些建筑材料产生的放射性氡(222 86Rn)对人体有危害。该原子中的中子数为
A.86 B.222 C.136 D.无法确定
2.有同温、同压、同体积的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO和CO2所含氧原子的个数比是
A.1:2 B.2:1 C.1:1 D.1:4
3.今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是
A 1︰1︰1 B 3︰2︰1 C 3︰2︰3 D 1︰1︰3
4.若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则
A. x=2,y=2 B. x=2,y=4 C. x=3,y=6 D. x=3,y=8
5.在N2+3H2 ![]() 2NH3中,表示该反应速率最快的是
2NH3中,表示该反应速率最快的是
A.υ(N2) = 0.5mol·L-1·S-1 B.υ(H2) = 1.0 mol·L-1·S-1
C.υ(NH3) = 0.8mol·L-1·S-1 D.υ(H2)= 20.0 mol·L-1·min-1
6.下列液体pH>7的是
A、人体血液 B、蔗糖溶液 C、橙汁 D、胃液
7.一元强酸和一元强碱恰好完全中和时,它们一定相等的是:
A、体积 B、质量 C、物质的量浓度 D、H+和OH– 的物质的量
8.在48mL0.1mol/LCH3COOH溶液中加入12mL0.4mol/LKOH溶液时,所得到的溶液是:
A、弱酸性 B、中性 C、强酸性 D、碱性
9.下列物质的水溶液,pH大于7的是
A.SO2 B . NH3 C .NH4Cl D . Na2SO4
10. 63%的硝酸(密度为1.40g/cm3)的物质的量浓度为
A.![]() B.
B.![]()
C.1000mL×1.40g/mL×63% D.![]()
11.在0.5mol O2中
A.含0.5mol氧原子 B.含1个氧分子
C.约含6.02×1023个氧分子 D.质量为16g
12.m L硫酸铝溶液含有n mol Al3+,则溶液中SO42-物质的量浓度为
A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
13.将10mL 5mol/L的HCl溶液加水稀释至200mL,再从中取出10mL,则此10mL溶液的物质的量浓度为(单位为mol/L)
A.0.25 B.0.1 C.0.5 D.0.05
14.用氢气还原某+2价金属元素的氧化物使其成为单质,每40g此氧化物需1g氢气,则此金属的相对原子质量是
A.64 B.56 C.40 D.24
15.在0.5L溶液里含有0.1mol氯化钠和0.2mol氯化镁,则此溶液中氯离子的物质的量浓度为(单位为mol/L)
A.0.3 B.0.5 C.0.6 D.1
16.下列物质完全燃烧时生成的CO2和H2O的质量比为11∶9的是
A.甲烷 B.乙烯 C.丁炔 D.乙烷
17.下列物质中,物质的量最多的是
A.56g氮气 B.1.5mol氯气
C.22.4L水(标准状况) D.3.01×1023个磷酸分子
18.将5g由两种金属组成的混合物,放入足量盐酸中,在标准状况下共收集到2.24L氢气,这种金属混合物组成可能是
A.锌和铁 B.镁和钙 C.镁和锌 D.铁和铜
19.n g氧气里有m个氧原子,由此可推出阿伏加德罗常数为
A.![]() B.
B.![]() mol-1 C.
mol-1 C.![]() D.
D.![]() mol-1
mol-1
20.将一定量的镁和铝分别与足量的盐酸反应,若放出氢气的质量相等,则参加反应的镁和铝的物质的量之比为
A. 1:1 B.2:3 C.3:2 D.8:9
21.15克A物质和10.5克B物质完全反应,生成7.2克C物质、1.8克D物质和0.3摩E物质,则E的摩尔质量是 ( )
A.111克/摩 B.100克/摩 C.55克/摩 D.105克/摩
22. 在一个2L的容器中,盛入6mol某气态反应物。30s后测得这种气态反应物还剩5.4mol,这种反应物的化学反应速率为
A. 0.02mol/L·s B. 0.012mol/L·s C. 0.01mol/L·s D. 0.03 mol/L·s
23. 等体积的盐酸和氢氧化钠溶液分别与两份足量铝粉反应,在相同条件下产生相同体积的氢气。则盐酸和氢氧化钠溶液物质的量浓度之比为
A. 1:1 B. 2:1 C. 3:1 D. 2:3
24.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同的情况下的反应速率分别如下,其中反应速率最大的是:
A.v(A)=0.15mol/(L•min) B. v(B)=0.6mol/(L•min)
C. v(C)=0.4mol/(L•min) D. v(D)=0.5mol/(L•min)
25.4g氢氧化钠固体溶于20 ml水中,所得碱液的密度1.15g/cm3.则该碱液的物质的量浓度是
A.20.0 mol/L B.5 mol/L C.4.8mol/L D.0.5mol/L
26.标准状况下,在一活塞式的密闭容器中,充入2.24L的NO,再小心充入1.12LO2,反应完毕,仍恢复至标准状况,则下列叙述正确的是
A.气体体积仍为2.24L B.气体体积应小于2.24L
C. 气体体积应大于2.24L D. 该气体在标准状况下的密度为2.05g/L
27.标准状况下,有①6.72L甲烷②3.01×1023个氯化氢分子,③13.6g硫化氢,④0.2mol氨气,则下列关系表示正确的是①②③④
A. 体积④<①<②<③ B.密度 ①<③<④<②
C. 原子总数④<①<③<② D.氢原子数②<④<③<①
28.15g由甲烷和乙烯组成的混合气通过盛有溴的四氯化碳溶液的洗气瓶,洗气瓶质量增加了7g。则原混合气中甲烷与乙烯的质量比及体积比分别是( )
A.15:7,2:1 B.8:7,1:2 C.8:7,2:1 D.15:7,1:2
二、填空题
29.填写下表:
| CO2的质量/g | CO2物质的量/mol | 标准状况下CO2的体积/L | O物质的量/mol | C的质量/g |
| 8.8 |
|
|
|
|
| 1 | ||||
| 6.72 | ||||
| 1 | ||||
| 3 |
30.1 molN2与1 molCO2相比,所含分子数之比为____________,原子数之比为_________;
物质的量相同的氮气和二氧化碳气体在相同条件下的体积之比为___________ 。
31.34gNH3中约含有_______ 个NH3分子,在标准状况下约占__________ L。
将其全部溶于水中得到0.5 L溶液,物质的量浓度为 ___________mol·L—1;若1体积水
(密度为1g/cm3)吸收了560体积(标准状况)氨气,则此氨水的质量分数为 。
32.在常温下,将等质量的Zn粒分别投入10mL0.1mol.L-1盐酸溶液和10mL氢离子浓度为0.1mol/L醋酸溶液中:
(1)写出Zn粒与醋酸反应的离子方程式:____________________________________。
(2)反应刚开始时,反应速率的快慢关系是盐酸_ 醋酸;若在盐酸和醋酸中生成相同的氢气,所需要的反应时间为盐酸 醋酸。(均填“>”或“<”或“==”)
(3)若Zn足量,产生H2的量的关系为:盐酸产生氢气的量________________醋酸产生氢
气的量。(填“>”或“<”或“==”)
33. 取1mol / LAlCl3溶液60mL,加入一定量的NaOH溶液,结果得到2.34g的Al(OH)3沉淀。加入的溶液中NaOH的物质的量可能为 mol或 mol。
34.(1)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:
SiO2+2C![]() Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
Si+2CO↑,在该反应中氧化剂是_____________________________,被氧化
的物质与被还原的物质的物质的量之比是____________________________。
(2)请写出铜和稀硝酸反应的化学方程式: ,若制得标准状况下的气体 4.48L,则参加反应的硝酸的物质的量为________ mol,转移电子的物质的量为________ mol.
三.计算题(本题有2小题,共12分。)
35.将足量的铝粉投入到100 mL 1.0 mol/L的氢氧化钠中,充分反应后能得到标准状况下的氢气多少升?
36.”摇头丸”是严厉查禁的毒品.食用该毒品后会使头颈摇摆不停,严重破坏中枢神经,已知某摇头丸的主要成分为M,M分子中含碳80.0%,氢9.63%,氮10.37%,它的蒸汽密度是氢气的67.5倍.求:
(1)M的相对分子质量
(2)M的分子式
37.取一定量的NH4NO3和(NH4)2SO4固体混合物,分成质量相等的两等份。一份与足量的NaOH浓溶液共热,在标准状况下收集到6.72LNH3,;另一份加水完全溶解后,加入过量的BaCl2溶液得到11.65g白色沉淀。试计算:
(1)原固体混合物中(NH4)2SO4的质量。
(2)原固体混合物中氮元素的质量分数。
38.向100mL含HCl的AlCl3溶液中逐滴加入0.1 mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:
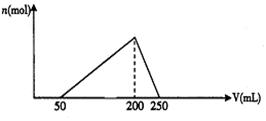 试计算:
试计算:
(1)原溶液中HCl的物质的量浓度.
(2)原溶液中AICl3的物质的量浓度.
39.取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出。试计算:
⑴原混合物中Na2CO3和Na2SO4的物质的量浓度。
⑵产生的气体在标准状况下的体积。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | D | B | A | A | D | D | B | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | A | A | D | A | C | C | D | C |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| C | C | C | D | C | B | D | C |
30.1:1 2:3 1:1
31. 1.2x1024 44.8 4 30%
32.
33. 0.09 0.12
34. SiO2 2:1 (2) 0.8 0.6
35. 3.36
36. 135 C9H13N
37. 6.6g 18.6%
38. 0.05mol/L 0.2mol/L 11.2L