高二化学上周练练习题
1. 在含有酚酞的 0.1 mol/L 氨水中加入少量 NH4Cl 晶体,则溶液颜色
A. 变深 B. 变浅 C. 变蓝色 D. 不变
2. 体积相同的盐酸与醋酸,当c(Cl- ) = c(CH3COO - )时,则它们的
A. pH相同 B. 物质的量浓度相同
C. 吸收NH3 体积一样 D. 都稀释一倍后,c(Cl- )与c(CH3COO - ) 仍相同
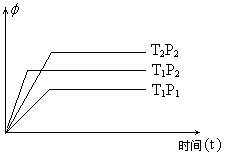 3. 在容积一定的密闭容器中存在如下反应:
3. 在容积一定的密闭容器中存在如下反应:
A(g)+B(g)![]() xC(g);生成物C的体积分数
xC(g);生成物C的体积分数![]() 与外界条件温度、压强的关系如下图,相关的判断正确的是
与外界条件温度、压强的关系如下图,相关的判断正确的是
A.T1<T2 、P1>P2、a<0、x<3
B.T1>T2 、P1<P2、a>0、x>3
C.T1>T2 、P1<P2、a<0、x<3
D.T1>T2 、P1>P2、a>0、x<3
4. 下列事实不能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 将FeCl3溶液加热蒸干最终得不到FeCl3固体
C. 实验室可用排饱和食盐水的方法收集氯气
D. 将滴有酚酞试液的Na2CO3溶液加热,溶液颜色加深
5. 在水溶液中能大量共存的离子组是
A. Na+ Fe3+ Cl- SCN- B. K + S2- SO2-4 H +
C. K + Al3+ Cl- AlO-2 D. Fe2+ Na+ NO-3 SO2-4
6. 25℃时,某溶液中由水电离出的H+的浓度为1×10![]() mol/L,下列说法正确的是
mol/L,下列说法正确的是
A.当a>7时,水的电离一定受到促进 B.当a<7时,水的电离一定受到抑制
C.当a>7时,溶液的pH为a或14-a D.当a<7时,溶液的pH为a或14-a
7. 已知NaHSO4 在水中的电离方程式为:NaHSO4 = Na + + H + + SO2-4 。某温度下,向 pH = 6 的蒸馏水中加入NaHSO4 晶体,保持温度不变,测得溶液中的pH为 2 。对于该溶液,下列叙述不正确的是
A. 该温度高于25℃
B. 水电离出来的c(H +)=1×10 - 10 mol ·L-1
C. c(H +)= c(OH -)+ c(SO2-4 )
D. 该温度下加入等体积 pH为 12 的NaOH 溶液可使反应后的溶液恰好呈中性
8. 现有物质的量浓度均为 0.1 mol·L - 1 的下列五种物质的溶液:①HCl ②H2SO4 ③ CH3COOH ④ NH4Cl ⑤ NaOH。其溶液中由水电离出的c(H +) 的大小关系是
A. ① = ②>③>④>⑤ B. ④>③>① = ⑤>②
C. ③>①>②>④>⑤ D. ④>③>①>⑤>②
9. 将 a g 含NaOH的样品溶解在b mL 0.1 mol·L-1 的 H2SO4 中,再加入 c mL 0.1mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是
A. [(b—c)/125a ]× 100% B. [(b—2c)/125a ]×100%
C. [(b—c)/250 a ] ×100 % D. [(8b—8c)/ a]× 100%
10. 混合相同物质的量浓度的200 mL Ba(OH)2溶液和150 mL NaHCO3溶液,最终所得溶液中各离子物质的量浓度大小顺序为
A. c(OH-)=c(Na+)>c(Ba2+)>c(HCO-3) B. c(OH-)>c(Ba2+)>c(HCO-3)>c(Na+)
C. c(OH-)>c(Ba2+)>c(Na+)>c(CO2-3) D. c(OH-)> c(Na+)>c(Ba2+)>c(CO2-3)
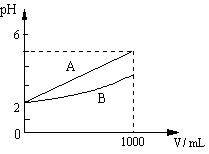 11. pH = 2的A、B两种酸溶液各取1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如右图所示,其中A的pH变为α。则下列说法不正确的是
11. pH = 2的A、B两种酸溶液各取1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如右图所示,其中A的pH变为α。则下列说法不正确的是
A. 稀释后A溶液的酸性比B溶液弱
B. A、B两溶液物质的量浓度一定相等
C. α= 5 时,A是强酸,B是弱酸
D. 当2<α<5时,A、B均为弱酸
12. 某物质的溶液其pH = 11 ,若向该溶液中加水稀释为原来的 100 倍,所得溶液的pH为: 9<pH<11,则该物质可能是
A. 强碱 B. 弱碱 C. 强酸弱碱盐 D. 强碱弱酸盐
2008级 班 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
13. 现有浓度均为0.1mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤CH3COONa ⑥KCl ⑦NH4Cl ⑧NaOH,这些溶液pH由小到大的顺序是(填序号) 。
14. 水解反应是广泛存在的一类重要反应,盐类水解反应是其中的一例。反应过程是反应物组成中显正电荷的部分与水分子电离出的OH- 结合,显负电性的部分与水分子电离出的 H+ 结合,且水解产物越难电离其水解反应就越彻底。写出下列物质发生水解反应的方程式:
(1)PCl5: ;
(2)Ca3P2: ;
(3)Mg3C2: ;
(4)BrCl: 。
15. 某工厂排放的废水,经测定含有游离Cl2 0.001 m ol·L-1,还有0.008 mol·L-1的H+,现采用亚硫酸钠除去其中的游离氯,有关反应为:Na2SO3 + Cl2 + H2O == Na2SO4 + 2 HCl,要处理这样的废水5 L。
(1)需加0.5 mol·L-1的Na2SO3溶液 mL才能把游离Cl2完全除去。
(2)处理后的废水的pH为 。
16. 在400℃,1.01×105 Pa时,将一定物质的量的SO2和14 mol O2压入一个装有催化剂的2 L密闭容器中,发生反应:2
SO2 (g)+ O2(g) ![]() 2 SO3(g);(正反应为放热反应),反应进行10 min后达到平衡,测得容器内有2 mol SO2和4 mol SO3。求:
2 SO3(g);(正反应为放热反应),反应进行10 min后达到平衡,测得容器内有2 mol SO2和4 mol SO3。求:
(1)SO2的转化率,用O2表示的该反应的反应速率。
(2)平衡时SO3的体积分数,平衡前后体系压强之比。
(3)达平衡后再加入2 mol SO2、12 mol O2、4 mol SO3,此时正反应速率将 ,逆反应速率将 ,化学平衡 移动。
高二(上)化学周练(一)答案
1~12: B A C A D C D B A D B BD
13. ②①③⑦⑥⑤⑧④
14. PCl5+ 4 H2O == H3PO4 + 5 HCl;
Ca3P2+ 6 H2O == 3 Ca(OH)2 +2 PH3;
Mg3C2+ 6 H2O == 3Mg(OH)2 +C2H6; BrCl+ H2O == HBrO + HCl。
15. 10 mL,2
16. 66.7%,0.1 mol(L·min)-1;22.2%,10∶9;增大,增大,正