高二化学上周练练习题
相对原子量:Ba=137 S=32 O=16 H=1
选择题(每题只有一个正确答案)
1. 下列物质属于电解质的是
A. 氯气 B. 氢氧化钠 C. 二氧化硫 D. 蔗糖
2. 下列物质属于强电解质的是
A. 醋酸 B. 硫化钠 C. 氨水 D. 水
3. 下列物质能导电的是
A. 酒精 B. 氯化钠固体 C. 熔融状态的氯化钠 D. 液氨
4. 下列溶液导电性最弱的是
A. 1mol/L KNO3 B. 0.1mol/L HCl C. 0.1mol/L H2SO4 D. 0.1mol/L H2S
5. 向0.01mol/L的氢硫酸(H2S)溶液中加入NaOH固体,下列说法正确的是
A. c(H+)增大 B. 溶液导电性减小 C. c(S2-)增大 D. 电离程度减小
6. 一定温度下,向10ml 0.1mol/L的HAc溶液和10ml 0.1mol/L的HCl中投入足量的锌粒,下列说法正确的是
A. 反应起始速率相等 B. 生成的H2质量相等
C. 原溶液的 pH相等 D. 原溶液的导电性相等
7. 99℃时蒸馏水的pH
A. 等于7 B. 大于7 C. 小于7 D. 8
8.下列离子方程式中错误的是
A. 碳酸钙与盐酸反应 CaCO3+2H+ →Ca2+ + H2O +CO2↑
B. 铁和稀硫酸反应 2Fe + 6H+ →2Fe3+ + 3H2↑
C. 氯气通入溴化钾溶液中 Cl2 + 2Br- →2Cl- + Br2
D. 氨水和盐酸中和 NH3·H2O + H+ →NH+ 4 + H2O
9. 下列离子方程式书写正确的是
A. 漂白粉溶液中加入稀HCl ClO- + H+ →HClO
B. 硫酸中加入氢氧化钡 Ba2+ + SO2-4 → BaSO4↓
C. 硝酸和氢氧化铜 H+ +OH- → H2O
D. 醋酸和氨水 CH3COOH + OH- → H2O + CH3COO-
10. 下列各组离子,在溶液中能大量共存的是
A. Ba2+ 、K+ 、 CO2-3 、 Cl- B. SO2-3 、 OH-、 Na+、 H+
C. Ag+、 H+、 I-、 NO3- D. Ca2+、 Fe3+、 NO3-、 Cl-
11. 可以鉴别K2CO3 、Na2SO4 、Na2S 三种无色溶液的一种试剂是
A. BaCl2 B. AgNO3 C. HCl D. NaCl
12. 下列微粒中,能发生水解的是
A. H+ B. Na+ C. Al3+ D. SO2-4
13. (NH4)2SO4溶液中,c(NH+ 4 )和c(SO2-4 )的关系是
A. 相等 B. 等于2比1 C. 小于2比1 D. 大于2比1
14. 已知0.1mol/L的NaX,NaY,NaZ三种盐溶液的pH值分别问10,9,11,则HX,HY,HZ三种酸酸性的强弱顺序为
A. HX>HY>HZ B. HY>HX>HZ C. HZ>HX>HY D. HZ>HY>HX
15. 用盐酸做标准液滴定待测浓度的NaOH溶液,若用甲基橙做指示剂,当滴定达到终点时,溶液颜色变化是
A. 由红色变橙色 B. 由黄色变红色 C. 由黄色变橙色 D. 由橙色变黄色
16. 一支25mL的滴定管内盛溶液,液面在15.00mL刻度处,将滴定管内液体全部排出时,所得溶液体积为
A. 10.00mL B. 15.00mL C. 小于10.00mL D. 大于10.00mL
17. 中和滴定过程中,下列操作不会引起实验误差的是
A. 滴定管内壁有蒸馏水滴就注入标准液
B. 滴定管内壁有蒸馏水滴就注入待测液
C. 锥形瓶内壁有蒸馏水滴,用待测液润洗后再加入待测液
D. 锥形瓶内壁有蒸馏水滴,直接装入待测液后进行滴定
2008级 班 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18. 写出下列离子反应方程式:
(1)Fe和CuSO4溶液反应 _________________________________________
(2)BaCO3和HCl溶液 _________________________________________
(3)FeCl3和NaOH溶液 _________________________________________
(4)(NH4)2SO4与Ba(OH)2溶液共热____________________________________
19. 0.1mol/L的下列溶液:1H2SO4 2HCl 3NH4Cl 4NaCl 5CH3COONa
6 NaOH 7Ba(OH)2按pH值由大到小的顺序排列是(填编号)_____________________。
20. 某研究性课题小组在某一温度条件下,做了冰醋酸(即无水固态醋酸)加水稀释的实验,同时测定了溶液导电能力的变化情况,并绘制了图象,请回答下列问题:
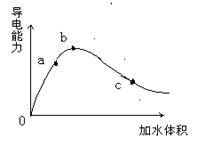
(1) 在“0”点导电能力为零,原因是_____________________________________
(2) 在a,b,c三点导电能力由大到小的顺序是____________
(3) 在a,b,c三点离子浓度由大到小的顺序是____________
21. 在160mL未知浓度的稀硫酸中,加入100mL浓度为0.4mol/L的BaCl2溶液,生成白色沉淀,反应后H2SO4有剩余,尚需加入48mL浓度为2mol/L的NaOH溶液才能使溶液的pH为7,试计算:
(1)写出有关反应的化学反应方程式______________________________________ ___
(2)求白色沉淀BaSO4的质量(要写计算过程)
(3)原H2SO4溶液的物质的量浓度为多少?(要写计算过程)
化学周练(二)
参考答案
选择题:1B 2B 3C 4D 5C 6B 7C 8B 9A 10D 11C 12C 13C 14B 15C 16D 17D
18. 略
19. 7,6,5,4,3,2,1
20.(1)冰醋酸中离子浓度为零
(2)b>a>c
(3) b>a>c
21. (1) 略 (2) 9.32g (3) 0.3mol/L