高二化学上学期测试试题
化学试题
可能用到的相对原子质量:C 12 N 14 O 16 S 32 Fe 56 Cu 64
注意事项:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共五大题23个小题。
满分108分。考试时间90分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.希望考生认真分析,仔细审题;答题要求规范,卷面整洁。
4.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试
题卷上。
5.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第Ⅰ卷 (选择题 共48分)
一、 选择题(本题包含16个小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1. 判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂
是( )
B A.浓盐酸 B.硝酸 C.王水 D.稀硫酸
2.下列各组物质互为同素异形体的是 ( )
(A)红磷与白磷 (B)磷酸与偏磷酸 (C)NO2与N2O4 (D)![]() Cl和
Cl和![]() Cl
Cl
3.下列离子方程式书写正确的是 ( )
A.氯化铵溶液与氢氧化钠稀溶液混合:NH4++OH—=NH3↑+H2O
B.稀HNO3和Cu反应:Cu+4H++NO3—=Cu2++NO2↑+2H2O
C.硝酸和氧化铜反应:2H++2NO3—+CuO=Cu(NO3)2+H2O
D.氨气与盐酸反应:NH3+H+=NH4+
4.下列试剂保存方法正确的是 ( )
(A)氢氟酸保存在玻璃瓶中 (B)白磷放在煤油中
(C)浓HNO3放在棕色瓶中 (D)钠放在冷水中
5.同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气
体,则两容器内的气体一定具有相同的( )
A.分子数 B.质子数 C.质量 D.密度
6.下列不能用勒夏特列原理解释的是 ( )
A.棕红色NO2加压后颜色先变深后变浅
B. 冰镇啤酒打开瓶塞后产生大量泡沫
C. 在H2,I2(g)和HI组成的平衡体系中加压后,混和物颜色加深
D.Fe(SCN)3溶液中加入固体KSCN后颜色变化
7.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到1.12L(标准状况下)气
体,则所消耗硝酸的物质的量是 ( ) ( )
A、0.12mol B、0.11mol
C、0.09mol D、0.08mol
8、下列说法中正确的是
A.氮元素是活泼的非金属元素,因此其单质的化学性质也很活泼
B.二氧化氮溶于水生成硝酸,因此二氧化氮是硝酸的酸酐
C.雷雨时,可增加土壤中硝酸盐类氮肥的变化属于氮的固定
D.氨气可作焊接金属的保护气
9.在一定温度下,密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如下
图,下列表述中正确的是( )
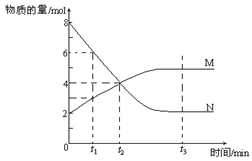 A.反应的化学方程式为:2 M
A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到了化学平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
10.下列反应中, 硝酸只表现出酸性的是( )
(A) 3Cu + 8HNO3 (稀) = 3Cu (NO3)2 + 2NO↑+ 4H2O
(B) 4HNO3 (浓) +C 4NO2↑+CO2↑+ 2H2O
(C) 4HNO3 (浓) 4NO2↑+O2↑+ 2H2O
(D) CaCO3 + 2HNO3 = Ca (NO3)2 +CO2↑+ H2O
11.合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是
①减压 ②加压
③升温 ④降温
⑤及时从平衡混合物中分离出NH3
⑥充入N2或H2
⑦加催化剂 ⑧减小N2或H2的量
A. ①③④⑤⑦ B. ②⑥
C.②⑤⑥ D. ②③⑥⑦
12.下列各组离子可以大量共存的是( )。
(A) H+、K+、Fe2+、NO3–
(B) OH–、Na+、Cl–、NH4+
(C) Mg2+、Cl–、K+、NO3–
(D) Ag+、NO3–、Na+、S2–
)
13.在一定温度和压强下,将装有NH3和NO2混合气体的试管倒立在水中,经足够时间后,
试管内气体的体积缩小为原体积的1/6,则原混合气体中NH3与NO2的体积比是( )
A.1:1 B.3:2
C.1:3 D.5:1
14.一定温度时于密封容器中发生反应:mA(g)+nB(g) ![]() pC(g),达平衡后,若将气体体积
pC(g),达平衡后,若将气体体积
压缩到原来的1/2。当再达平衡时C的浓度是原来的1.9倍。若压缩过程中温度保持不变,则下
列叙述正确的是( )
A.平衡向正反应方向移动
B.C气体的质量分数增大
C.气体A的转化率降低
D.m+n>p
15.一定温度下,在一个容积固定不变的密闭容器中进行X(g)+3Y(g) ![]() 4Z(g)+W(s)反应,达
4Z(g)+W(s)反应,达
到平衡状态的标志是 ( )
①气体的密度不再变化 ②单位时间内生成amolX,同时生成3amolY
③气体的压强不再变化 ④单位时间内生成3amolY,同时生成4amolZ
A.②④ B.②③ C.①④ D.①②
16.M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中
M的化合价是 ( )
A.+1 B.+3 C.+4 D.+6
高二年级化学试卷成绩统计表(考生不要填写)
| 题 号 | 一 | 二 | 三 | 四 | 五 | 总分 | |||
| 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| ||
| 得 分 |
|
|
|
|
|
|
|
| |
第I卷答题栏(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共60分)
二、填空题(本题包括2小题,共21分).
17 (共15分)
A、(8分)用双线桥表示下列反应中得失电子的情况,该反应的氧化剂 、
氧化产物 、该反应中被还原的HNO3与未被还原的HNO3的质量
之比为 。
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
B、(3分)配平:
SO32- + MnO4- + H+ — Mn2+ + SO42- + H2O
C、(4分)在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的
关系是 ;
(2)A、C是气体,增加B的量,平衡不移动,则B为 态;
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的
方向是 ;
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
18.(6分)在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生
如下反应:X(g)+Y(g)![]() 2Z
(g)。(正反应是放热反应)
2Z
(g)。(正反应是放热反应)
(1)反应达到平衡后,若降低温度,化学反应速率 ,Z的浓度 。
(填“增大”、“减小”或“不变”)。
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
|
|
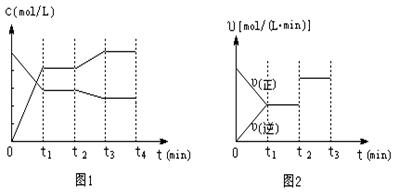
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
。(用文字表达)。
由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
 三、分析与推断:(共11分)
三、分析与推断:(共11分)
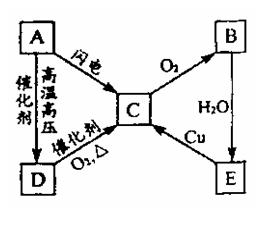
19.(11分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下
都是气体,B为红棕色,回答下列问题。
(1)下列物质的化学式为:
B: C: E:
(2)下列反应的化学方程式:
A→D:
A→C:
B→E:
D→C:
四、实验题(本题只有2小题,共17分)
20、(3分)工业上拟用铜和硝酸来制备Cu(NO3)2·3H2O,下面是三个同学提出的生产方案:
甲方案:铜+浓HNO3—→蒸发结晶
乙方案:铜+稀HNO3—→蒸发结晶
丙方案:铜![]() 氧化铜
氧化铜![]() 蒸发结晶
蒸发结晶
你认为________方案最好,理由是___________________________________________。
21、(14分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
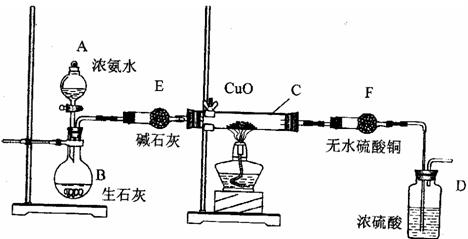
(1)写出烧瓶B中发生反应制氨气的化学方程式:
用平衡移动原理解释能用此法制取氨气的原因:
。
(2) 本实验进行一段时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色
硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现
象,写出在硬质玻璃试管内发生反应的化学方程式:
_______________ __________ __,这个反应说明氨气具有______________
(填编号:A、碱性 ;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶D中盛浓硫酸的主要作用是 ________ _________。
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置F的作用是____ _______________。
五、计算题(本题包括2小题,共11分)
22. (3分)用接触法制5吨98%的浓硫酸在理论上需要含FeS2 70%(杂质不含硫元素)的硫铁
矿(设还有2%的硫留在炉渣内)为 t(结果用分式表示)。
23.(8分)在容积为3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过5min后达到化学平衡,此时容器中含有0.9mol N2,1.2mol H2,3mol NH3,
则H2起始浓度为 ,
N2的转化率 。
用H2表示的反应速率V(H2)= ,
平衡时混合气体的平均相对分子质量为 。(写出计算过程)
解:
期中考试试卷 参考答案
一、选择题(本题包含16个小题,每小题3分,共48分。)
1-8BADCA CBC ;9-16 DDBCA CCD
第Ⅱ卷(非选择题 共60分)
二、(本题包括2小题,共21分)
17.(15分)
A、(8分 )该反应的氧化剂HNO3、氧化产物Fe(NO3)3。
该反应中被还原的HNO3与未被还原的HNO3的质量
之比为 1:9 。(各2分)
 失去3e-
失去3e-
3FeO + 10HNO3 ==3Fe(NO3)3 +NO↑ + 5H2O (各2分)
得到3e-
B、(3分)配平:5SO3![]() + 2MnO4
+ 2MnO4![]() + 6H
+ 6H![]() == 2Mn
== 2Mn![]() + 5SO4
+ 5SO4![]() + 3H2O
+ 3H2O
C、(4分)(1)m+n<p (2)固或液(3)逆反应方向 (4)吸热(各2分)
18.(6分)(1)减小,增大 2分
(2)t2 时对平衡体系降温 2分 b d (有错不给分2分)
三、分析与推断:(共11分)
19.(1)NO2 NO HNO3 (各1分)
(2)A→D:
A→C:N2+O2![]() 2NO
2NO
B→E: 3NO2+H2O====NO+2HNO3
D→C: 4NH3+5O2![]() 4NO+6H2O(各2分)
4NO+6H2O(各2分)
三、实验题(本题包括2小题,共17分)
20.(3分)丙(1分)
因为生成等质量的产品,丙方案消耗的原料HNO3最少,且无污染(2分)
21、(14分)(1)化学方程式:NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2 (2分),
用平衡移动原理解释能用此法制取氨气的原因:
氨水中存在NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4+ + OH― 平衡,生石灰与水反应产生OH―且 放热使平衡左移,促进了氨的挥发。(2分)
NH4+ + OH― 平衡,生石灰与水反应产生OH―且 放热使平衡左移,促进了氨的挥发。(2分)
(2)写出在硬质玻璃试管内发生反应的化学方程式: 2NH3+3CuO△= N2+3Cu+3H2O (2分) B (2分)
(3)D中盛浓硫酸的主要作用是干燥N2 ,除去过量NH3 (2分)
(4) C (2分)
(5)装置F的作用是检验C处反应 有无H2O的产生 (2分) (每空2分)
四、(本题包括2小题,共11分)
22 (3分). ![]() 或
或![]() 或4.37t
或4.37t
23.(8分)(1)25、(1)1.9 mol/L (2)62.5% (3)0.3 mol·(L·min)—1 (4)15.4
| |