高二化学上月考测试卷
化 学
(时间100分钟,分值120分)
一、选择题(每小题有1到2个正确答案,共72分)
1.在450C密闭容器中进行下列反应:2SO2(g)+O2(g) ![]() 2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是
2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是
A.v(O2)=1.5×10—3 mol·L—1·s—1 B.v(O2)=1.5×10—4mol·L—1·s—1
C.v(SO2)=3.0×10—3 mol·L—1·s—1 D.v(SO3)=3.0×10—5 mol·L—1·s—1
2.已知下列热化学方程式
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l);△H=-445.15kJ·mol-1
CO2(g)+H2O(l);△H=-445.15kJ·mol-1
CH4(g)+![]() O2(g)=CO(g)+2H2O(l);△H =-607.3
kJ·mol-1
O2(g)=CO(g)+2H2O(l);△H =-607.3
kJ·mol-1
CH4(g)+2O2(g)=CO2 (g)+2H2O(l);△H =-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2 (g)+2H2O(g);△H =-802.3 kJ·mol-1
则甲烷的燃烧热为
A.445.15kJ·mol-1 B.607.3 kJ·mol-1 C.890.3 kJ·movl-1 D.802.3 kJ·mol-1
3.已知:H2(g)+I2(g)![]() 2HI(g)的平衡常数为K1;
2HI(g)的平衡常数为K1;![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数为K2,则K1、K2的关系为
HI(g)的平衡常数为K2,则K1、K2的关系为
A.K1=2K2 B.K1= K22 C.K1 = K2 D.K1= K2
4.对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)=5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
5.己知胆矾溶于水时温度降低,室温下,将1mol无水硫酸铜配成溶液时放出的热量为Q1kJ,又知胆矾分解的热化学方程式为∶ CuSO4•5H2O(s)=CuSO4(s)+5H2O(l) ΔH=+Q2kJ/mol 则Q1、Q2的关系为
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
6.在密闭容器中进行下列反应:M(气)+N(气)![]() R(气)+2L(?),该反应中
R(气)+2L(?),该反应中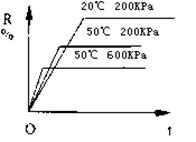 R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是
R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是
A.正反应为放热反应,L为气体
B.正反应为吸热反应,L为气体
C.正反应为吸热反应,L为固体或液体
D.正反应为放热反应,L为固体或液体
7.常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮和空气,已知:2NO2![]() N2O4;△H<0.现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码。在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是
N2O4;△H<0.现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码。在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是
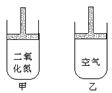 A.①甲>乙 ②甲>乙
A.①甲>乙 ②甲>乙
B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙
D.①甲>乙 ②甲=乙
8.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1
C(s)+1/2O2 (g)=CO(g);△H2
②S(s)+O2 (g)=SO2(g);△H3
S(g)+O2 (g)=SO2(g);△H4
③H2(s)+1/2O2(g)=H2O(g);△H5
2H2 (g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7
CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.③④ C.②③④ D.①②③
9.把1mL0.1mol/LH2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+接近于
A.1×10-4mol/L B.1×10-8mol/L C.1×10-11mol/L D.1×10-10mol/L
10.下列反应中熵减少的是
A.食盐晶体溶于水 B.氢气在氧气中燃烧生成液态水
C.碳酸氢铵分解 D.水蒸气冷凝为水
11.在0.1mol/L的CH3COOH溶液中,要促进醋酸电离,且氢离子浓度增大,应采取的措施是
A.升温 B.加水 C.加入NaOH溶液 D.加入稀HCl
12.T °C时A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(2)所示。则下列结论正确的是
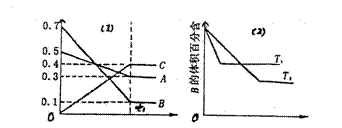
图(1) 图(2)
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡向逆反应方向移动
B.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.T °C若由0.4mol/L A、0.4mol/L B、0.2mol/L C反应、达到平衡后,C的浓度仍为0.4mol/L
D.(t1+10)min保持压强不变,通入稀有气体,平衡向正反应方向移动
13.等体积的0.1mol/L的盐酸与0.06mol/L的Ba(OH)2溶液混合后,溶液的pH等于
A.2.0 B.12.3 C.1.7 D.12.0
14.某恒温恒容的容器中,反应2A(g)![]() B(g)建立了平衡。若再向容器中通入一定量的A气体或B气体,重新达到平衡后,有关容器内A、B的体积分数说法正确的是
B(g)建立了平衡。若再向容器中通入一定量的A气体或B气体,重新达到平衡后,有关容器内A、B的体积分数说法正确的是
A.气体A的体积分数比原平衡时大,气体B的体积分数比原平衡时小
B.气体A的体积分数比原平衡时小,气体B的体积分数比原平衡时大
C.气体A、B的体积分数都比原平衡时小
D.气体A、B的体积分数都比原平衡时大
15.有体积相同、相等pH的烧碱溶液和氨水,下列叙述中正确的是
A.两溶液物质的量浓度相同
B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH-离子浓度相同
D.加入等体积的水稀释后,pH仍相等
16.在一个固定体积的密闭容器中,加入2 molA和1 molB发生如下反应:2A(g)+B(g) ![]() 3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2 mol/L的是
3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2 mol/L的是
A.4 mol A十2 mol B
B.3 mol C+1 mol D+l mol B
C.3 mol C十0.8 m01 D
D.1.6 mol A+0.8 mol B+0.6 mol C+0.3 mol D
17、下列事实不能用勒夏特列原理解释的是
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
18、已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
19.(每空3分,共39分)
(1)发射“神州六号”载人飞船的长征火箭是用肼(N2H4)燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g)△H =67.7 kJ·mol-1;
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H =-534 kJ·mol-1;肼与二氧化氮反应的热化学方程式为 。
(2)已知下列反应 :H2(g)=2H(g) ΔH1=+Q1 kJ/mol
O2(g)=2O(g) ΔH2=+Q2 kJ/mol
2H(g)+O(g)=H2O(g) ΔH3=-Q3 kJ/mol
H2O(g)=H2O(l) ΔH4=-Q4 kJ/mol
H2(g)+ 1/2O2(g)=H2O(l);ΔH5=-Q5 kJ/mol
试指出Q1、Q2、Q3、Q4、Q5的等量关系:
20、把温度为13℃,浓度为1.0 mol·L-1的酸溶液和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3·H2O | 13 | 19.3 | △H2 |
(1)试计算上述两组实验测出的中和热:△H1=________;△H2=________。
 (2)实验中碱液过量的目的是________________________________。
(2)实验中碱液过量的目的是________________________________。
(3)两组实验结果差异的原因是________________________________。
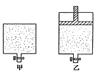
21.有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(1)在甲容器中加入2mol三氧化硫和1mol N2,乙容器中加入2mol二氧化硫和1mol氧气,起始时容积相同,在相同的温度下(500℃)反应均达平衡。则两容器内压强甲________乙,(填大于、小于或等于,下同);容器内混合气体的平均相对分子质量甲______乙。
(2)若在两个容器中,甲中加入2mol三氧化硫,乙中加入4mol三氧化硫,起始时两容器内的温度和压强均相同,反应过程中,温度保持一定。若达平衡后,甲容器内三氧化硫的物质的量为a mol,则乙容器中三氧化硫的物质的量__________2a mol。(填,大于、小于或等于)。
 22.在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a
mol·L-1。
22.在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a
mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)=
mol·L-1·min-1;
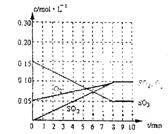
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
23.(4分)由N2和H2合成1molNH3时可放出46.2kJ的热量。从手册上查出N≡N键的键能是948.9kJ·mol-1;H-H键的键能是436.0 kJ·mol-1。试计算N-H键的键能是多少?
24.(5分)在温度为373K时,把11.5g N2O4气体通入体积为500ml的真空密闭容器中立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器中混合气体的密度是氢气密度的28.75倍,则:
(1)开始时2s内以c(N2O4)的变化表示的反应速率是多少?
(2)达到平衡时体系内的压强是开始的多少倍?
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | B | A | A | A | B | C | D | BD |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | B | C | CD | AC | AB |
19、N2H4(g)+NO2(g)= N2(g)+2H2O(g) △H=-567.9kJ·mol-1
2Q5+2Q1+Q2=2Q3+2Q4
20、(1)根据给出的酸和碱的物质的量,酸为0.050mol,碱为0.055mol,碱是过量的,应以酸计算,算出生成0.050mol水放出的热量,进而算出生成1mol水放出的热量,即可得出两组实验测出的中和热数值。
![]()
![]()
(2)碱液过量是为了提高实验准确度,因NaOH溶液易吸收CO2,而使NaOH浓度下降,NH3·H2O易挥发也使NH3·H2O浓度下降。
(3)NaOH是强碱,在水溶液中完全电解,跟HCl中和时放热较多,NH3·H2O是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少
 21、(1)大于; 小于
21、(1)大于; 小于
(2)小于
22、(1)0.0025mol/L. min
(2)a=0.05 mol/L 图象如右
(3) BD(漏选得1分,错选不给分)
23、391.6
24、(1)v(N2O4)=![]()
(2)![]()