高二化学上期末复习题
化学定时练习 一 (45分钟) 命题:岳全国
相对原子质量:H:1 O:16 Mg:24 Al:27 Fe:56 Cu:64 S:32 Ba:137
选择题:(每小题5分,共60 分,每小题有1~2个正确选项)
1.下列哪种物质溶于水时,电离出的阳离子能使水的电离平衡向右移动
A.HNO3 B.NH3·H2O C.(NH4)2SO4 D.Na2CO3
2.下列有关纯铁的描述正确的是
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中可钝化 D.在潮湿的空气中比生铁容易被腐蚀
3.用某种容器对一种液体进行体积计量,设正确读数为n mL,仰视读数为x mL,俯视读数为y mL,若x>n>y,则所用量器是
A.量筒 B.酸式滴定管 C.容量瓶 D.碱式滴定管
4.某溶液中加入铝粉能产生氢气,在此溶液中可能大量共存的离子组是
A.Ba2+、Na+、OH-、NO3- B.AlO- 2 、Na+、NO- 3 、K+
C.Na+、K+、HCO- 3 、SO2-4 D.Mg2+、K+、H+、NO- 3
5.pH都是3的醋酸和盐酸分别稀释相同的倍数,两溶液中由水电离出的c(H+)的比值
A.等于1 B.小于1 C.大于1 D.无法判断
6.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②③ C.②⑤ D.④⑥
7.将0.2 mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) B.c(Na+)<c(CN-)
C.c(HCN)﹣c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1 mol/L
8.下列反应的离子方程式正确的是
A.铝片和氢氧化钠溶液反应 Al+2OH-=AlO- 2 +H2↑
B.少量氯气通入FeBr2溶液中 2Fe2++Cl2=2Fe3++2Cl-
C.氢氧化铁放入氢碘酸溶液中 Fe(OH)3+3H+=Fe3++3H2O
D.向Al2(SO4)3溶液中加入Ba(OH)2溶液至沉淀达到最大值
 2Al3++3SO2-4 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
2Al3++3SO2-4 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
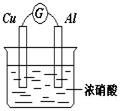
9.有如图所示的装置,下列说法正确的是
A.Cu是原电池的负极
B.Al是原电池的负极
C.电流表的指针偏向铜
D.铝片上的电极反应式为:Al-3e-=Al3+
10.将pH=1的盐酸平均分成2份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水和NaOH溶液的体积比为
A.9 B.10 C.11 D.12
11.将Cu片放入0.1 mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中
c(Fe3+)︰c(Fe2+) = 2︰3,则Cu2+与Fe3+的物质的量之比为
A.3︰2 B.3︰5 C.4︰3 D.3︰4
![]() 12.下列各种物质中,一定能用溴水加以鉴别的是
12.下列各种物质中,一定能用溴水加以鉴别的是
![]() A.CH4与C3H8
B.
与 C6H10
A.CH4与C3H8
B.
与 C6H10
![]()
![]() C.CCl4与
D.
与 -CH3
C.CCl4与
D.
与 -CH3
班 姓名
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
13.(12分)将一块镁、铝合金中的镁、铝以沉淀形式分开,下列操作步骤的括号内表示选用的试剂或生成物:
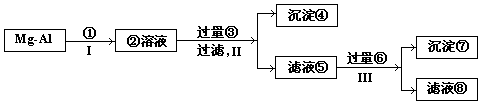
写出反应II和III的化学方程式:
II___________________________________,_____________________________
![]() III_____________________________________________________
III_____________________________________________________
![]() 14.(8分)2H2+O2
2H2O反应,构成燃料电池,则正极电极反应式为:_______________________,其溶液的pH
(填“变大”、“变小”、或“不变”)
14.(8分)2H2+O2
2H2O反应,构成燃料电池,则正极电极反应式为:_______________________,其溶液的pH
(填“变大”、“变小”、或“不变”)
15.(8分)推断苯乙烯(右图)有如下性质:①催化加氢
②硝化 ③被酸性KMnO4溶液氧化 ④加聚
(1)苯基部分可发生 反应(填序号);
(2)―CH=CH2部分可发生 反应(填序号)。
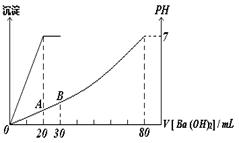 16.(12分)有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol·L-1的Ba(OH)2溶液时,生成的BaSO4的质量和混合溶液的pH如图所示关系,计算:
16.(12分)有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol·L-1的Ba(OH)2溶液时,生成的BaSO4的质量和混合溶液的pH如图所示关系,计算:
(1)最初混合液中硫酸和盐酸的物质的量浓度。
(2)在B点溶液的pH。
高二(上)化学定时练习 一 答案
1C 2C 3BD 4AB 5B 6C 7D 8BD 9A 10C 11D 12C
13.Ⅱ.MgCl2+2NaOH=Mg(OH)2↓+2NaCl AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
Ⅲ.NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
14.正极:O2+2H2O+4e-=4OH- 大
15.(1) ①② ; (2) ①③④ 。
16.解:
![]()
![]()
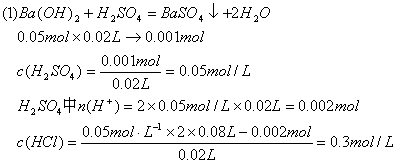
(2)B点时溶液中的酸还差50mLBa(OH)2才能恰好中和:50mLBa(OH)2中的OH-为0.05L×2×0.05mol/L=0.005mol未被中的![]() pH=1
pH=1
高二(上)化学定时练习 一 答案
1C 2C 3BD 4AB 5B 6C 7D 8BD 9A 10C 11D 12C
13.Ⅱ.MgCl2+2NaOH=Mg(OH)2↓+2NaCl AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
Ⅲ.NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
14.正极:O2+2H2O+4e-=4OH- 大
15.(1) ①② ; (2) ①③④ 。
16.解:
![]()
![]()
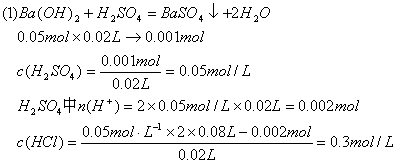
(2)B点时溶液中的酸还差50mLBa(OH)2才能恰好中和:50mLBa(OH)2中的OH-为0.05L×2×0.05mol/L=0.005mol未被中的![]() pH=1
pH=1