高二理科化学第一学期期末教学目标检测
高二化学(理科)
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 分数 | ||||||
| 阅卷人 |
考生须知:本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,将第I卷选
择题的答案答在第I卷后的“答题卡”上。
有关相对原子质量:H―1 O―16 C-12 Mg —24 S-32 Fe―56
第I卷(选择题 共50分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意,将正确答案填写在I卷最后的答题卡上)
1、物质的量浓度相等、体积相等的一元强酸和一元弱碱相互反应,所得溶液 ( )
A、呈酸性 B、呈碱性 C、呈中性 D、无法判断
2、将稀硫酸和氯化镁分别滴加到下列溶液中,均有白色沉淀生成的是 ( )
A、BaCl2 B、Ba(OH)2 C、Na2CO3 D、Fe 2(SO4)3
3、一定条件下,在密闭容器中进行反应:2A(g)+B(g)![]() 2C(g),下列说法中可以说明这个反应已经达到平衡状态的是
( )
2C(g),下列说法中可以说明这个反应已经达到平衡状态的是
( )
A、A、B、C的浓度相等 B、A、B、C在容器中共存
C、A、B、C的浓度不再发生变化 D、单位时内生成2 molA,同时生成1mol的B
4、下列物质中,互为同系物的是 ( )
![]()
![]() A、CH3CH3和CH3CH=CH2
B、CH CH和CH3CH=CH2
A、CH3CH3和CH3CH=CH2
B、CH CH和CH3CH=CH2
![]()
![]() C、CH3CH2CH2CH3和CH3CHCH3
D、
和
C、CH3CH2CH2CH3和CH3CHCH3
D、
和
CH3
5、下列物质中,既能发生加成反应,也能发生取代反应,并能使酸性高锰酸钾溶液褪色的是 ( )
A、CHCl3 B、苯 C、甲苯 D、乙烷
6、当酸碱恰好完全中和时,下列叙述中正确的是 ( )
A、反应的离子方程式为:H++OH-=H2O
B、加入酸的浓度、体积与加入碱的浓度、体积相等
C、酸中的c(H+)与加入碱的c(OH-)相等
D、加入酸提供的n(H+)与加入碱提供的n(OH-)相等
7、下列物质充分反应后,滴入KSCN溶液,溶液呈红色的是 ( )
A、FeO+HCl(aq) B、过量的Fe+HNO3(aq) C、FeCl2(aq)+Cl2 D、Fe+CuSO4(aq)
8、1989年世界卫生组织将铝定为食品污染源之一。铝在下列应用时需要加以控制的是①制电线 、②制炊具、③明矾净化饮用水、④明矾和苏打做食品的膨松剂、⑤用氢氧化铝制胃药 ( )
A、只有⑤ B、只有④⑤ C、只有①⑤ D、除①外
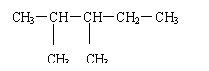 9、有机物
d 的名称是
( )
9、有机物
d 的名称是
( )
A、2-甲基-3-乙基丁烷 B、2-乙基-3-甲基丁烷
C、2,3-二甲基戊烷 D、3,4-二甲基戊烷
10、实验室为了完成下列实验,其选用的试剂或操作的方法不正确的是 ( )
A、除去镁粉中混有少量的铝粉,加入足量的氢氧化钠溶液,过滤、洗涤、干燥
B、除去铁制器皿表面的镀铜层,加入足量的浓硝酸,洗涤、干燥
C、除去甲烷中混有少量的乙烯,将混合气体通入足量的溴水,洗气
D、除去硝基苯中混有的硝酸,加入足量的水,过滤
二、选择题(本题包括10小题,每小题2分,共20分,每小题有一个或两个选项符合题意;若正确答案
只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分;将正确答
案填写在I卷最后的答题卡上)
11、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
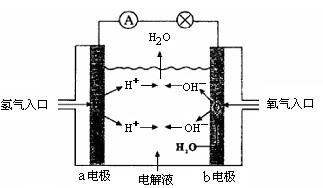
A、b电极是正极
B、总反应方程式为: 2H2 + O2 == 2H2O
C、负极发生还原反应,正极发生氧化反应
D、氢氧燃料电池是一种具有应用前景的绿色电源
12、下列反应属于取代反应的是 ( )
A、甲烷在空气中完全燃烧 B、乙烯与溴的四氯化碳溶液反应
C、甲苯与浓硫酸、浓硝酸混合制备三硝基甲苯 D、由氯乙烯制备聚氯乙烯
13、在下列反应中,最终仍有沉淀的是 ( )
A、澄清石灰水中通入过量二氧化碳 B、偏铝酸钠溶液中滴加过量盐酸
C、明矾[KAl(SO4)2·12H2O ]溶液中滴加过量氢氧化钡溶液 D、硝酸铝溶液中滴加过量氨水
14、8.4g 铁粉与3.2g硫粉均匀混合加热充分反应,冷却后加入足量的盐酸,在标准状况下得到的气体的体积是 ( )
A、1.12L B、2.24L C、3.36L D、4.48L
15、下列分子中的原子一定在同一平面上的是( )
①CH4 ②C2H4 ③C2H2 ④C6H6 ⑤C2H6
A、只有②③④ B、除①外 C、只有②③ D、全部是
16、下列物质中,既能与NaOH溶液反应,又能与盐酸反应的是 ( )
A、NaHSO4 B、Al(OH)3 C、Na2SO3 D、NaHCO3
17、下列说法中正确的是( )
A、分子组成上相差一个或若干个CH2原子团的物质一定是同系物
B、分子组成相同的物质一定是同分异构体
C、符合通式CnH2n+2(n>1)的有机物一定和甲烷互为同系物
D、具有相同通式的物质一定属于同系物
18、常温的下列溶液中,水的电离程度与pH=3的氯化铵溶液中水的电离程度相同的是 ( )
A、pH=3的醋酸溶液 B、pH=11的碳酸钠溶液
C、0.001 mol / L的盐酸 D、0.001 mol / L 的NaOH溶液
19、等温等容的条件下有下列反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立
C(g)+3D(g)。现分别从两条途径建立
平衡:I、反应由正反应方向开始,A和B的起始浓度均为2 mol/L;II、反应由逆反应方向开始,C和D
的起始浓度分别为 2 mol/L 和6 mol/L 。下列叙述中正确的是 ( )
A、I和II中A的平衡浓度相等
B、I和II中A的体积分数相等
C、I和II中混合气体的平均相对分子质量不相等
D、I中混合气体的密度是II中混合气体密度的![]()
20、某FeSO4、Fe2(SO4)3、H2SO4 的混合溶液100 mL,已知阳离子的浓度相等(不考虑水解),且
c(SO42-)=6 mol / L,则此溶液最多还可以溶解铁的质量为 ( )
A、11.2 g B 、16.8 g C、19.6 g D、22.4 g
答题卡:
一、选择题(每小题3分,共30分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二、选择题(每小题2分,共20分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
第II卷(非选择题 共50分)
| 阅卷人 | 分数 |
|
|
|
三、填空题(本题包括4小题,共26分)
21、某密闭容器中有如下可逆反应:2SO2 (g)+O2
(g)![]() 2SO3 (g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
2SO3 (g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
(1)升高温度,v(正)___________,v(逆)___________,SO2 的转化率_____________。
(2)加正催化剂,v(正)___________,v(逆)___________,O2 的物质的量___________。
(3)缩小容器的体积,SO3的物质的量___________,SO2的转化率______________。
22、在相应的空格内填写大于、等于或小于:
(1)分别取pH=2的硫酸和醋酸各50mL,加入足量的镁粉,反应开始时,反应速率前者_________后者;充分反应后,相同条件下产生氢气的体积前者_________后者。
(2)等浓度等体积的盐酸和醋酸,分别与等浓度的NaOH溶液反应,恰好中和时,消耗NaOH的体积前者__________后者,所得溶液的pH前者________后者。
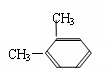
23、1mol 某芳香烃完全燃烧得到8 mol的CO2 和5 mol 的H2O ,请回答下列问题:
(1)该芳香烃的分子式为_____________。
(2)若该烃只有一个取代基,则该烃的结构简式为______________;若该芳香烃发生硝化反应时,其苯环上的一硝基取代物有________种。
(3)若该烃有两个取代基,则该烃可能的结构简式为_______________________、_____________________、
______________________。
24、A~J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已经略去)。已知A是一种高熔点的化合物,D是一种红棕色的固体,H的焰色反应呈黄色。
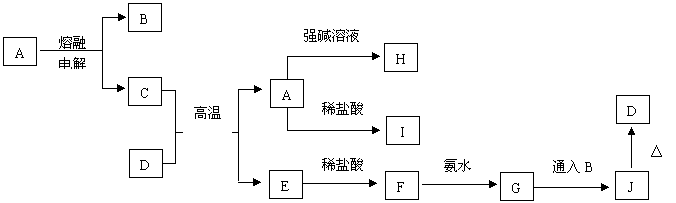 |
请回答下列问题:
(1)A物质的化学式为______________,H物质的化学式为___________________。
![]() (2)G J的化学方程式为_________________________________________________________。
(2)G J的化学方程式为_________________________________________________________。
(3)若D与盐酸恰好反应,改反应的离子方程式为______________________________________,常温下所得溶液的pH______(填大于、小于、等于)7,其原因是(用离子方程式表示)_______________________________________。
(4)不纯的E在潮湿的空气中易发生电化学腐蚀,其负极发生的电极反应式是_______________________;正极发生的电极反应式是_______________________________。
| 阅卷人 | 分数 |
|
|
|
四、实验题(本题包括2小题,共15分)
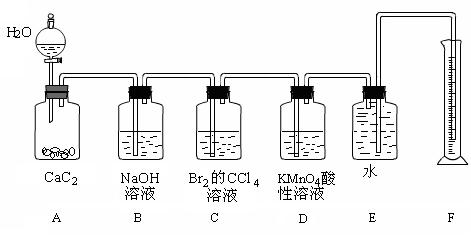 25、实验室用如图装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
25、实验室用如图装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
(1)实验室制乙炔反应的化学方程式是____________________________________________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用__________来代替水。
(2)装置B中盛放有足量的NaOH溶液的作用是______________________________________________,反应的离子方程式是____________________________________________。
(3)装置C中观察到的现象是________________________,反应的方程式是________________________________________________,该反应的类型是____________。
(4)装置D中观察到的现象是_______________________,该反应的类型是____________。
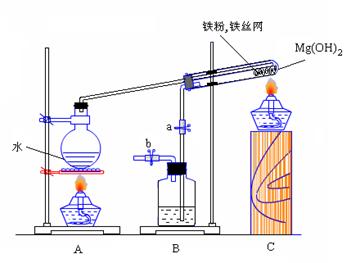 26、某课外研究小组,利用下列实验装置来完成“铁与水蒸气的反应”的实验,并检验气体产物。大试管中盛放是:(1)Mg(OH)2 ,在受热分解后能产生350℃的水蒸气,使得反应获得足够高的热量;(2)铁粉和铁丝网,铁丝网的作用是为了加大铁粉与水蒸气的接触面,并加大传热的效率。该实验能加快反应的速率,提高实验的成功率。
26、某课外研究小组,利用下列实验装置来完成“铁与水蒸气的反应”的实验,并检验气体产物。大试管中盛放是:(1)Mg(OH)2 ,在受热分解后能产生350℃的水蒸气,使得反应获得足够高的热量;(2)铁粉和铁丝网,铁丝网的作用是为了加大铁粉与水蒸气的接触面,并加大传热的效率。该实验能加快反应的速率,提高实验的成功率。
请你回答下列问题:
(1)写出铁与水蒸气反应的化学方程式________________________________________________________。
(2)装置B中盛放的是_______________,其作用是___________________________________________。
(3)在实验进行前必须进行的操作是_______________________;为了检验导管口b处的气体,在检验前必须进行的操作是_________________;
(4)实验完毕后的操作是__________________________________________________________________。
| 阅卷人 | 分数 |
|
|
|
五、计算题(本题包括1小题,共9分)
27、粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物,现进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.2 L 6.0 mol / L的盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出标准状况下4.48L的气体,生成溶液D,同时还有残留的单质B。请你填写下列空白:
(1)①中铝热反应的化学方程式是_______________________________________________________,产物中单质B的化学式是___________。
(2)③中反应的离子方程式是______________________________、_________________________________。
(3)20g A中n(Fe2O3)=______________;若溶液D的体积仍视为0.2L ,则该溶液中c(Mg2+)=______________,c(Fe2+)=_______________。
六、选做题:(共10分)
28、向50mL 0.018 mol / L的AgNO3 溶液中加入50mL0.020 mol / L的盐酸,生成沉淀。如果溶液中
c(Ag+)、c(Cl—)的乘积时一个常数:c(Ag+)×c(Cl—)=1.0×10-10( mol / L)2。(忽略体积误差)
计算:(1)完全沉淀后,溶液中c(Ag+)=_________________。
(2)完全沉淀后,溶液的pH=_______________。
(3)如果向完全沉淀后的溶液中继续加入50 mL0.001mol/L的盐酸,能否观察到现象?通过计算解释原因。
答案:
一、选择题(每小题3分,共30分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | C | D | C | D | C | D | C | D |
二、选择题(每小题2分,共20分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | C | CD | C | C | BD | C | B | BD | A |
三、填空题(26分,每空1分)
21、(1)增大,增大,减小 (2)增大,增大,不变(3)增大,增大
![]() 22、(1)等于,小于(2)等于,小于
22、(1)等于,小于(2)等于,小于
23、(1)C8H10 (2) ;3
![]()
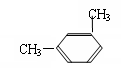 (3)
(3)
24、(1)Al2O3 ,NaAlO2 (2)4Fe(OH)2++2H2O +O2 =4Fe(OH)3 (3)Fe2O3+6H+=2Fe3++3H2O ;小于,Fe3++3H2O![]() Fe(OH)3+3H+ (4)2Fe-4e-=2Fe2+ ;2H2O +O2 +4e-=4OH-
Fe(OH)3+3H+ (4)2Fe-4e-=2Fe2+ ;2H2O +O2 +4e-=4OH-
四、实验题(15分,每空1分)
![]()
![]()
![]() 25、(1)CaC2+2H2O
25、(1)CaC2+2H2O
![]() Ca(OH)2+
CH CH ( 或C2H2)↑;饱和食盐水(2)除去H2S,否则H2S也能与Br2的CCl4溶液、酸性KMnO4溶液反应,H2S
+2OH-=S2-+2H2O
(3)溴的颜色(橙红色)逐渐褪去,CH CH+Br2
Ca(OH)2+
CH CH ( 或C2H2)↑;饱和食盐水(2)除去H2S,否则H2S也能与Br2的CCl4溶液、酸性KMnO4溶液反应,H2S
+2OH-=S2-+2H2O
(3)溴的颜色(橙红色)逐渐褪去,CH CH+Br2![]() CHBr=CHBr或CH CH+2Br2
CHBr=CHBr或CH CH+2Br2
![]() CHBr2CHBr2 ,加成反应(4)紫色逐渐褪去,氧化反应。
CHBr2CHBr2 ,加成反应(4)紫色逐渐褪去,氧化反应。
26、(1)3Fe+4H2O(g)![]() Fe3O4 +4H2
↑(2)浓硫酸,干燥氢气 (3)装置的气密性检查;检验氢气的纯度。(4)先熄灭A处酒精灯,然后关闭止水夹a,最后熄灭C处酒精灯。
Fe3O4 +4H2
↑(2)浓硫酸,干燥氢气 (3)装置的气密性检查;检验氢气的纯度。(4)先熄灭A处酒精灯,然后关闭止水夹a,最后熄灭C处酒精灯。
五、计算题(9分)
27、(1)(2分)2Al+Fe2O3 ![]() 2Fe+Al2O3 ;Fe(2)(2分)Fe+2H+=Fe2++H2
↑,Fe+2Fe3+=3Fe2+(3)0.1 mol(1分) ;0.5 mol / L(2分),2.5
mol / L(2分)(可以用Cl-守恒解)
2Fe+Al2O3 ;Fe(2)(2分)Fe+2H+=Fe2++H2
↑,Fe+2Fe3+=3Fe2+(3)0.1 mol(1分) ;0.5 mol / L(2分),2.5
mol / L(2分)(可以用Cl-守恒解)
六、选做题(10分)
28、(1)(3分)1.0×10-7 mol/L (2)(2分)2 (3)(4分)无明显现象,∵c(Cl—)没有改变,c(Ag+)变小,∴c(Ag+)×c(Cl—)<1.0×10-10 ,没有沉淀产生。