高二级化学上册半期考试试题
考试时间:100分钟 总分:110分
第一卷 选择题(共54 分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64 Fe-56
一、选择题(每小题只有一个选项符合题意,每小题 3分共54 分)
1.对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是:
4NO(g)+6H2O(g),下列叙述正确的是:
A.达到化学平衡时,4υ正(O2)=5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
2.下列关于浓HNO3与浓H2SO4的叙述正确的是:
A、露置于空气中,溶液浓度不变 B、常温下都能与铜较快反应
C、露置于空气中,溶液质量均减轻 D、常温下都可用铁制容器贮存
3.下列说法正确的是:
A.相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,[OH-]之比是2:1
B.在NH3+NaH=NaNH2+H2↑的反应中,NH3为还原剂
C.0.1 mol·L-1 NH4Cl溶液中的[NH4+]=[Cl-]
D.0.2 mol·L-1氨水溶液中,[NH4+]+[NH3]+ [NH3•H2O]= 0.2 mol·L-1
4.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
5.一定条件下反应mA(g)+
nB(g)![]() pC(g)+ qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是:
pC(g)+ qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是:
A.3、1、2、1 B.3、1、2、2 C.2、6、3、5 D.1、3、2、2
6.8g氮的氧化物NxOy 和50g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol Fe3O4和0.1mol N2,则NxOy是:
A. NO B. N2O3 C. NO2 D.N2O5
7.在可变容积的密闭容器中通入体积比为2:3的气体A和气体B,在一定条件下发生如下反应:A+3B![]() 2C
(A.B.C均为气体)当反应达化学平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是:
2C
(A.B.C均为气体)当反应达化学平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是:
A.5:6 B.5:4 C.5:3 D.5:2
8.在密闭容器中可逆反应aA(气)+bB(气)![]() cC(气)+dD(气)+Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是:
cC(气)+dD(气)+Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是:
A.a+b<c+d, Q<0 B.a+b>c+d, Q<0
C.a+b<c+d, Q>0 D.a+b=c+d, Q<0
9.下列除去杂质的操作方法正确的是:
A.NO2中有少量的NO:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的O2:通过灼热的铜网
D.红磷中有少量的白磷:加热到40℃,使白磷自燃
10.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是:
A.加入一种反应物
B.对平衡体系加压
C.升高温度
D.使用催化剂
11.下列事实中,不能用勒沙特列原理来解释的是:
A.在配制FeCl3溶液时,是先用稀盐酸溶解,再加水稀释至所需的浓度
B.使氢硫酸中加碱有利于S2-离子增多
C.500℃左右比室温更有利于合成氨反应
D.高压条件有利于合成氨反应
12.同温同压下,当反应物分解了8%时,总体积也增加8%的是:
A.2NH3(g)
![]() N2(g)+3H2(g)
N2(g)+3H2(g)
B.2NO(g) ![]() N2(g)+O2(g)
N2(g)+O2(g)
C.2NO3(g) ![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
D.2NO2(g)
![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
13.在平衡体系H2S![]() H++HS-
和HS-
H++HS-
和HS-![]() H++S2-
中,溶液 PH值增大时,则C(S2-):
H++S2-
中,溶液 PH值增大时,则C(S2-):
A.增大 B.减小 C.不变 D.可能增大可能减小
14.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是:
A.Cl-、NO3-、Ca2+、Na+ B.Na+、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
15.下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是: A.FeCl2 、 FeCl3 B.Na2CO3 、 NaHCO3
C.NaAlO2 、AlCl3 D.Mg(HCO3)2 、 MgCl2
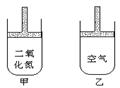 16.常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮和空气,已知:2NO2
16.常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮和空气,已知:2NO2![]() N2O4;正反应是放热反应。现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码。在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是:
N2O4;正反应是放热反应。现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码。在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是:
A.①甲>乙 ②甲>乙
B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙
D.①甲>乙 ②甲=乙
17.在4500C密闭容器中进行下列反应:2SO2(g)+O2(g) ![]() 2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是:
2SO3(g),若起始时c(SO2)=0.010mol/L,c(O2)=0.02mol/L,10s后气体压强为起始时的95%,则该反应的平均反应速率是:
A.v(O2)=1.5×10—3 mol·L—1·s—1
B.v(O2)=1.5×10—4mol·L—1·s—1
C.v(SO2)=3.0×10—3 mol·L—1·s—1
D.v(SO3)=3.0×10—5 mol·L—1·s—1
18.T℃时A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(1)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(2)所示。则下列结论正确的是:
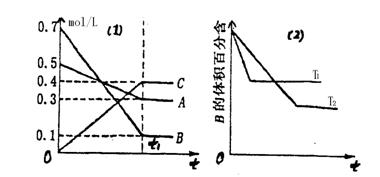 |
图(1) 图(2)
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡向逆反应方向移动
B.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.T℃时若由0.4mol/L A、0.4mol/L B、0.2mol/L C反应、达到平衡后,C的浓度仍为0.4mol/L
D.(t1+10)min保持压强不变,通入稀有气体,平衡向正反应方向移动
化学试卷答题卷
第一卷 选择题(共54 分)
一、选择题(3×18=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第二卷 非选择题(共56分)
二、填空题(56分)
19.(8分)久置的浓硝酸发黄是因为__________________________________________;液氨常用做制冷剂,其原因是_________________________________________;实验室制氨的化学反应方程式是________________________________________,
用______________________________________(操作)检验NH3是否充满集气瓶。
20.(6分)反应A(g)+B(s)![]() C(g) (正反应为放热反应);达到平衡后,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g) (正反应为放热反应);达到平衡后,在其他条件不变时,改变其中一个条件,则生成C的速率:
(1) 升温___ ; (2) 增大压强____ _; (3) 增大容器容积____ ;
(4) 加入A ; (5) 加入B____ __; (6) 加正催化剂____ 。
21.(10分)可逆反应3A(g)![]() 3B(?)+C(?)(正反应吸热)达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
3B(?)+C(?)(正反应吸热)达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
⑴若B、C都是气体,气体的平均相对分子质量 ;
⑵若B、C都不是气体,气体的平均相对分子质量 ;
⑶若B是气体,C不是气体,气体的平均相对分子质量 ;
⑷若B不是气体,C是气体。
①如果A的摩尔质量大于C的摩尔质量,气体的平均相对分子质量 ;
②如果A的摩尔质量小于C的摩尔质量,气体的平均相对分子质量 。
22.(16分)(1)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:NaNO2+NH4Cl= NaCl+N2↑+2H2O↑+Q实验装置如图所示,试回答:
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是 _ (填写编号)
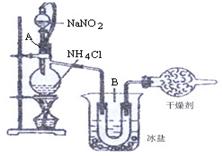 a.防止NaNO2饱和溶液蒸发
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
②B部分的作用是
a.冷凝
b.冷却氮气
c.缓冲氮气流
③加热前必须进行一个操作步骤是________________________________加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 ____________________________________
④收集N2前,必须进行的步骤是(用文字说明) ,收集N2最适宜的方法是(填写编号)
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
(2)实验室合成氨装置如图所示,试回答装置甲的作用是:
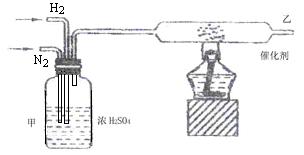
① ,② ,③ 。
从乙处导出的气体是 ,检验产物的简单化学方法 _________ 。
23.(4分)在100ml硝酸和硫酸的混合溶液中(浓度小于2mol/L),向其中加入5.76g铜粉,微热,使其充分反应;若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度分别是_____________________;_______________________。
24.(12)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1;
 (2)达到平衡时c(O2)=c(SO2),则a=
mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(2)达到平衡时c(O2)=c(SO2),则a=
mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |