高二化学会考复习氧化还原反应及能量变化测试
班级 姓名 学号
1、生产泡沫橡胶过程中,有如下一个反应:2H2O2=2H2O+O2↑。该反应中H2O2
A、既不是氧化剂,也不是不原剂 B、既是氧化剂又是还原剂
C、仅为氧化剂 D、仅为还原剂
2、下列微粒不具有还原性的是
A、H2 B、Fe2+ C、I- D、H+
![]() 3、 属于氧化还原反应的是
3、 属于氧化还原反应的是
A. MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
![]() B. Al2O3
+ 6HCl = 2AlCl3 + 3H2O
B. Al2O3
+ 6HCl = 2AlCl3 + 3H2O
C. 2NaHCO3 Na2CO3 + CO2↑+ H2O
D. NaOH + HCl = NaCl + H2O
4、下列反应既属于氧化还原反应,又是吸热反应的是
A.铝片与盐酸的反应 B.(NH4)2SO4固体和消石灰的反应
C.灼热的炭与CO2的反应 D.甲烷在氧气中的燃烧反应
5、下列反应属于吸热反应的是
A.Al + Fe2O3 的反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.N2 + H2 的反应 D.NaOH溶液与CH3COOH溶液反应
6、下列反应即属于氧化还原反应又属于置换反应的是
A.Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
![]() B.3Cu + 8 HNO3== 3Cu(NO3)2 +2 NO↑ + 4H2O
B.3Cu + 8 HNO3== 3Cu(NO3)2 +2 NO↑ + 4H2O
C.2Mg + CO2 C + 2MgO
D.CO +
H2O(g)![]() CO2 + H2
CO2 + H2
7、某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A.KMnO4 B.NaCl C.(NH4)2SO4 D.CH3COOH
8、 下列说法正确的是
A.化学反应必须遵守质量守恒和能量守恒
B.化学反应不一定都遵循质量守恒和能量守恒
C.化学反应前后分子个数相同
D.人们利用化学反应只是为了制取所需物质
9、下列物质中,不能氧化乙醛的是
A.氧气 B.氢气 C.新制的Cu(OH)2 D.酸性KMnO4
10、在体育锻炼中,消耗的能量主要来自于
A. 葡萄糖 B.脂肪 C. 蛋白质 D. 维生素
11、下列物质燃烧时,不会造成大气污染的是
A、石油 B、农作物秸秆 C、煤 D、氢气
12、一个A原子转移两个电子给两个B原子,下列说法正确的是
A、形成化合物的化学式为AB2,A是氧化剂;
B、形成化合物的化学式为AB,A被还原
C、形成化合物的化学式为AB2,B发生了还原反应
D、形成化合物的化学式为AB2,B具有还原性
13、下列说法错误的是
A、铜、锌原电池中铜是正极 B、NO气体既有氧化性又有还原性
C、N2只能作氧化剂不能作还原剂 D、稀酸也有氧化性
14、为了科学地饮食,了解一些与食品相关的化学知识是必要的。油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中最适宜充入的是
A.氮气 B.氢气 C. 氧气 D.臭氧
15、下列反应中,显示出硝酸强氧化性的是
A.碳与浓硝酸反应 B.碳酸钠与硝酸反应
C.氧化铁与浓硝酸反应 D.氢氧化铜与稀硝酸反应
16、化学电池在通讯、交通及日常生活中有着广泛的应用。目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
以下说法中正确的是:① 以上反应是可逆反应 ② 以上反应不是可逆反应 ③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A ①③ B ②④ C ①④ D ②③
17、下列金属冶炼的反应原理,错误的是
A、2NaCl(熔融) 2Na + Cl2↑ B、Al2O3 + 3CO 2Al + 3CO2
C、Fe3O4 + 4CO 3Fe + 4CO2 D、2HgO 2Hg + O2↑
18、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
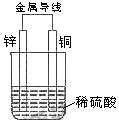 19、关于如图所示装置的叙述,正确的是( )
19、关于如图所示装置的叙述,正确的是( )
A、铜是负极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
20、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
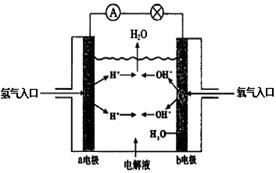 A. a电极是负极
A. a电极是负极
B. b电极上发生氧化反应
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
21、将NO3-+Zn+OH-+H2O→NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A.2 B.4 C.6 D.8
22、在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A. 1︰1︰1 B. 2︰2︰1 C. 2︰3︰1 D. 4︰3︰2
23、在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH - =RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B. +5 C.+6 D.+7
24、ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
25、实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是
A.F2→F- B.HNO3→NO C.Mg→Mg2+ D.Na2O2→O2
26、下列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
27、已知KH和H2O反应生成H2和KOH,反应中1 mol KH
A.失去1 mol电子 B.得到1 mol电子
C.失去2 mol电子 D.没有电子得失
28、下列粒子在化学反应中既能显示氧化性又能显示还原性的是
A.Al3+ B.Br- C.Al D.Fe2+
29、已知:(1)Co2O3在酸性溶液中易被还原成Co2+;(2)Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
30、水在下列反应中只作还原剂的是
A、C12+H2O=HCIO+HCl B、2Na+2H2O=2NaOH+H2↑
C、3NO2+H2O=2HNO3+NO D、2F2+2H2O= 4HF+O2
31、下列变化必须加入还原剂才能实现的是
(A). CuO→CuSO4 ( B). CO2→CO (C). KClO3→O2 (D). Fe→Fe3O4
32、 单质X和Y相互反应生成![]() 。现有下列叙述:(1)X被氧化;(2)X是氧化剂;(3)X具有氧化性;(4)
。现有下列叙述:(1)X被氧化;(2)X是氧化剂;(3)X具有氧化性;(4)![]() 是还原产物;(5)
是还原产物;(5)![]() 具有还原性;(6)
具有还原性;(6)![]() 具有氧化性;(7)Y的氧化性比
具有氧化性;(7)Y的氧化性比![]() 的氧化性强,其中正确的是
的氧化性强,其中正确的是
A. (1)(2)(3)(4) B. (1)(4)(5)(6)(7)
C. (2)(3)(4) D. (1)(3)(4)(5)
二、填空题
33.写出下列冶炼金属发生反应的化学方程式:
(1)工业上用一氧化碳还原三氧化二铁冶炼铁
____________________________________________________________________。
(2)铝粉和四氧化三铁混合后加热
____________________________________________________________________。
(3)点燃的镁条伸进氮气中继续燃烧
。
34.原电池是一种将 能转化为电能的装置,能构成原电池的物质间一定存在一个能自发的 反应。铜丝和铁丝拧在一起时铁丝更易腐蚀这是因为铁丝相当于是原电池的 极,比纯铁更易 电子;铁在干燥的空气中不易生锈而在潮湿的空气中较易生锈的原因也是形成了原电池,这时正极得电子的物质通常是空气中的 。
废旧电池不能随意丢弃这是因为废旧电池中含有的重金属离子会造成 和地下 的污染,威胁人类的健康。
三.简答题
35.(1)对于司机酒后驾车,可对其呼出的气体进行检验而查出。所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3 (绿色)+3CH3CHO+6H2O,被检测的气体成分是________________(填名称),上述反应的氧化剂是________________(填化学式),如果有1mol该物质被还原,则反应中共转移了_________________个电子 。
(2)NO是污染大气的有毒气体。为了消除NO的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,这种物质是 。该反应的化学方程式是 。
(3)汽车尾气产生的![]() 可以在一定条件下和
可以在一定条件下和![]() 反应生成无毒物,其反应式可表示为
反应生成无毒物,其反应式可表示为
![]() ,该反应的氧化剂是________,还原剂是________,每有1mol
,该反应的氧化剂是________,还原剂是________,每有1mol![]() 生成,反应中转移的电子为_____mol.
生成,反应中转移的电子为_____mol.
(4)工业上用碳在高温下与二氧化硅反应制取粗硅。反应的化学方程式为:
SiO2+2C![]() Si+2CO↑,在该反应中氧化剂是________ __________ ___________,
Si+2CO↑,在该反应中氧化剂是________ __________ ___________,
被氧化的物质与被还原的物质的物质的量之比是____________________ ________。
(5)根据4NH3+ 5O2== 4NO+6H2O的反应方程式,如果反应后得到l mol H2O,则反应中有________mol氮原子被氧化。
36.如右图示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一些镁带,
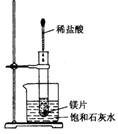 再用滴管滴入5ml盐酸于试管中。试回答下列问题:
再用滴管滴入5ml盐酸于试管中。试回答下列问题:
(1) 实验中观察到的现象:
① ;② .
(2)产生上述现象的原因是: .
(3)写出有关离子方程式: .
(4)由实验推知,MgCl2溶液和H2的总能量 .(填大于、小于 或等于)镁带和盐酸的总能量.
四、计算:
37.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | D | A | C | B | C | A | A | B | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | C | C | A | A | B | B | B | D | B |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| C | B | B | B | D | B | A | D | A | D |
31 B 32 B