选修3《物质结构与性质》模块测试题
广州市高二化学中心组提供
本测试卷分第Ⅰ部分(选择题)和第Ⅱ部分(非选择题),满分为120分,考试时间90分钟。
第Ⅰ卷 (选择题共 60 分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。)
1.元素“氦、铷、铯”等是用下列哪种科学方法发现的:
A.红外光谱 B.质谱 C.原子光谱 D.核磁共振谱
2.下列含氧酸中,酸性最弱的是
A.HClO B.HNO2 C.H2SO4 D.HIO4
3.下列能层中,有f能级的是
A.K B.L C.M D.N
4.根据电子排布的特点,Cu在周期表属于
A.s区 B.p区 C.d 区 D.ds区
5.下列元素的电负性最大的是:
A.Na B.S C.O D.C
6. 最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含σ键又含π键的是
A.N2 B.CO2 C.C2H4O D.H2O2
7. 下列物质在水中溶解性最好的是
A.CO2 B.NH3 C.SO2 D.CH4
8. 下列物质的沸点最高的是
A.H2O B.H2S C.H2Se D.HF
9. 某主族元素的原子,M层上有一个半充满的亚层,这种原子的质子数是
A.只能是7 B.只能是15 C.是11或15 D.是11或13
10.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
A.Ds原子在周期表中位于第7周期第ⅦB族 B.Ds是过渡元素
C.Ds原子的核外电子数为110
D.Ds为金属元素
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
11.下列物质不是配合物的是
A.NH4Cl B.KAl(SO4)2•12H2O
C.CuSO4•5H2O D.[Ag(NH3)2]OH
12. 下列基态原子或离子的电子排布式错误的是
A.K:1s22s22p63s23p64s1 B.Fˉ:1s22s22p6
C.Fe:1s22s22p63s23p63d54s3 D.Kr:1s22s22p63s23p63d104s24p6
13.原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是
A.XO3- B.XO32- C.XO42- D.XO43-
14. 下列式子中,能真实表示分子的组成的是
A.SiO2 B.C C.NaOH D.P4
15. 下面是一些原子的2p能级和3d能级中电子排布的情况,其中正确的是
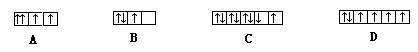
16. a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
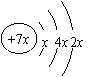 ,
b与c形成化合物的电子式为
,
b与c形成化合物的电子式为 ![]() 。下列比较中正确的是
。下列比较中正确的是
A.原子半径:a>c>d>b B.电负性a>b>d>c
C.原子序数:d>a>c>b D.最高价含氧酸的酸性c>d>a
17.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是
A.X:3s23p1 Y:3s23p5 B.X:2s22p3 Y:2s22p4
C.X:3s23p1 Y:2s22p5 D.X:2s22p3 Y:1s1
18.下列关于主族元素的说法正确的是
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最高正价等于主族的序数
D.主族元素的价电子数有可能超过最外层电子数
19.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
A.氯化硼液态时能导电而固态时不导电 B.硼原子以sp杂化
C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子属极性分子
20.下列数据是对应物质的熔点,有关的判断错误的是
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
第Ⅱ卷 (非选择题共 60 分)
三、(60分)
21.(10分)在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=A/n (K为A与n的比值)。请选编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素,
当K=l时,则该元素系_________元素,
当K<1时,则该元素系_________元素。
22.(10分)
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
(2)根据VSEPR模型,H3O+的分子立体结构为:___________ ________________,
BCl3的立体结构为:___________ _________________。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:
(各写一种)
正四面体分子_______,三角锥形分子________,V形分子_________。
23.(16分)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),
回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________,
如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________________________, 其中元素_______的第一电离能反常高的原因是
_________________________________________________________。
24.(12分)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_________,F元素原子的电子排布式_________________,
E元素的原子结构示意图是__________________
(2)化合物乙中含有的化学键是____________________________
(3)化合物甲为固体时属于________晶体,E单质在一定条件下与甲反应的化学方程式
为____________________________________________________________。
25.(12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),原因是__________________________
__________________________________________________________________
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,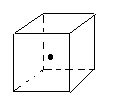
请在立方体的顶点用“· ”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________________
选修3《物质结构与性质》模块测试答卷
21.(10分)
(1)_____________(2)____________(3)_________,_________, _________
22.(10分)
(1)________ _______,__________ _______________________________
(2)___________ ________________,___________ _________________。
(3)________________,__________________,_____________________。
23.(16分)
(1)__________________ (2)________________(3)_______________
(4)_______________,___________________
(5)___________________________________________________________________
__________________________________________________,____________。
(6)___________________, _____________,______________________________
__________________________________________________________________。
24.(12分)
(1)_______________,___________________________,__________________
(2)____________________________________________
(3)__________________,_______________________________________________
25.(12分)
(1)________________; ________________
(2)____________,___________________________________________________
________________________________________________________________
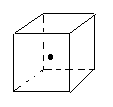 (3)
(3)
(4)________________________________________。
选修3《物质结构与性质》模块测试
参考答案与评分标准
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。)
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | D | D | C | B | B | A | C | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AB | C | AD | D | D | D | AD | BC | C | AB |
三、(60分)
21. (共10分)
(1)C (2)B (3)D A B (每空2分)
22. (共10分)
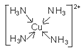 (1)Fe3+
(3分)
(1)Fe3+
(3分)
(2)三角锥形、正三角形 (4分)
(3)CH4或CF4,NH3或NF3,H2O (3分)
23. (共16分)
(1)E (2)D (3)C (4)p,TCl3 (每小题2分)
(5)电子分层排布,各能层能量不同 ,9 (每空2分)
(6)R<S<T,S,S元素的最外层电子处于s能级全充满,能量较低,比较稳定,失去一个电子吸收的能量较多 (4分)
 24. (共12分)
24. (共12分)
![]() (1)
1s22s22p63s23p5
(6分)
(1)
1s22s22p63s23p5
(6分)
(2) 离子键、共价键和配位键 (3分)
(3)分子 2Mg + CO2 点燃 2MgO + C (3分)
25. (共12分)
(1)>,< (4分)
(2)不能,物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多。因此不能都根据键能来判断物质的熔点高低。 (3分)
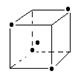
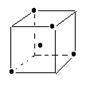 (3)(2分)
(3)(2分)
(4)+236 kJ/mol (3分)