高二化学第一学期中考试题
命题人:常国福 审题人:刘 喜
第一卷 (选择题共50分)
时量100分钟,满分120分,请考生把选择题答案填入答题卡内。
可能用到的相对原子质量数据有:Na—23 S---32 O—16 C-12 H—1
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. 北京市成为2008年第29届夏季奥运会的举办城市。为向世界展现一个新北京的形象,有关部门提出下列建议:①开发新能源,减少化石燃料的燃烧;②分类回收垃圾;③限制使用塑料袋和一次性塑料餐具;④提倡使用手帕,减少餐巾纸的使用;⑤农业上控制化肥和农药的使用。你认为可以采纳的是
A.①②③④ B. ①②④⑤ C. ②③④⑤ D. 全部
2. 本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
3. 决定化学反应速率的主要原因是
A.参加反应物质的性质 B.加入催化剂
C.温度和压强 D.各反应物和生成物的浓度
4.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
A.KMnO4 B.NaClO C.H2O2 D.Cl2
5. 升高温度时,化学反应速率加快,主要原因是
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的 。
D.该化学反应的过程是放热的
6. 下列物质的水溶液能导电,但属于非电解质的是
A.HClO B.Cl2 C.NH4HCO3 D.SO2
7.下面是合成氨的简要流程示意图:
![]()
|
|
|
 |
沿x路线回去的物质是
A.N2和H2 B.催化剂 C.N2 D.H2
8.下列各反应的化学方程式中,属于水解反应的是
A、H2O+H2O![]() H3O++OH-
B、HCO3-+OH-
H3O++OH-
B、HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C、CO2+H2O![]() H2CO3
D、CO32-+H2O
H2CO3
D、CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
9. 在室温下等体积的酸和碱的溶液,混合后PH一定等于7的是( )
A. PH=3的硝酸和PH=11的Ba(OH)2溶液 B. PH=3的盐酸和PH=11的氨水
C. PH=3的硫酸和PH=11的氨水 D. PH=3的醋酸和PH=11的Ba(OH)2溶液
10. 25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离出的OH-离子浓度之比为
A.1010:1 B.5×109:1 C.108:1 D.1:1
11. 在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)![]() H2 (g) + I2 (g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是
H2 (g) + I2 (g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是
A.HI、H2 、I2的浓度相等 B. HI、H2 、I2的浓度不再发生变化
C.HI、H2 、I2在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
12. 下列离子方程式中,书写正确的是
A. HCO3- + H2O === H2CO3 + OH- B. CO32- + 2H2O === H2CO3 + 2OH
C. Fe3+ +3H2O ![]() Fe(OH)3 +3H+ D. NH4+
+ H2O
Fe(OH)3 +3H+ D. NH4+
+ H2O ![]() NH3·H2O +OH-
NH3·H2O +OH-
13.在某一化学反应中,反应物A的浓度在20 s内从1.0 mol / L变为0.2 mol / L,则在这20 s内A的化学反应速率为
A. 0.04 mol / L B. 0.04 mol / (L·s)
C. 0.08 mol / L D. 0.08 mol / (L·s)
14.《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A.水的电离过程是放热的过程 B.盐的水解一定能促进水的电离
C.催化剂能提高水分解的转化率 D.金属的腐蚀一定与水无关
15.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是
A.0.1mol·L-1的亚硝酸溶液的pH约为2
B.100mL 1mol·L—1的亚硝酸溶液恰好与100mL 1mol·L—1的NaOH溶液完全应
C.用亚硝酸溶液作导电性试验,灯泡很暗
D.HNO2溶液与NaCl溶液不能发生反应
16、若溶液中由水电离产生的![]() ,满足此条件的溶液中一定可以大量共存的离子组是( )
,满足此条件的溶液中一定可以大量共存的离子组是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() B.
B. ![]() 、
、![]() 、
、![]() 、HCO3-
、HCO3-
C. ![]() 、
、![]() 、
、![]() 、
、![]() D.
D. ![]() 、
、![]() 、
、![]() 、
、![]()
17、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后,c(X2)为0.4mol/L,c(Y2)为0.8mol/L,生成的Z为0.4mol/L,则该反应式是
A、X2+2Y2![]() 2XY2
B、2X2+Y2
2XY2
B、2X2+Y2![]() 2X2Y
2X2Y
C、3X2+Y2![]() 2X3Y
D、X2+3Y2
2X3Y
D、X2+3Y2![]() 2XY
2XY
18. 下列事实不能用勒夏特别原理解释的是( )
A. 加入催化剂能加快![]() 转化为
转化为![]()
B. 配制![]() 溶液时,向溶液中加入少量盐酸
溶液时,向溶液中加入少量盐酸
C. 往醋酸溶液中加少量碱,有利于![]() 的增多
的增多
D. 往醋酸钠溶液中加入纯醋酸,可以抑制![]() 的水解
的水解
19.某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
20、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A、电离程度:HCN>HClO
B、溶液的pH:HCN<HClO
C、与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
D、酸根离子浓度: C(CN-)<C(ClO-)
21、可逆反应A(g)+3B(g)![]() 2C(g)(正反应为放热反应)处于平衡状态,下列条件中可以提高A的转化率的是:①高温②低温③高压④低压⑤加催化剂⑥除去C⑦增加A ⑧增加B ( )
2C(g)(正反应为放热反应)处于平衡状态,下列条件中可以提高A的转化率的是:①高温②低温③高压④低压⑤加催化剂⑥除去C⑦增加A ⑧增加B ( )
A、①③⑤⑦ B、②④⑥⑧ C、②③⑥⑧ D、②④⑤⑦
22、对于反应2SO2+O2 ![]() 2SO3,下列判断正确的是
(
)
2SO3,下列判断正确的是
(
)
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变时,增大压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动。
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
23、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
( )
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
( )
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
24. 常温下,将醋酸和氢氧化钠溶液混合,所得溶液![]() ,则此溶液中( )
,则此溶液中( )
A. ![]() B.
B.
![]()
C. ![]() D. 无法确定
D. 无法确定
25、PH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的PH仍然相同,则X、Y、Z的关系是( )
A. X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z
化学试题 2007、11、
第一卷答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | # |
| 答案 | # |
第二卷 (共70分)
二、填空题:(本题包括8小题,共35分)
26、(3分)在 ①NaCl、②NH4Cl、③CH3COONa三种盐溶液中,呈酸性的是
(填序号,下同),呈中性的是 ,呈碱性的是 。
27.(3分)有A、B、C三种无色气体,分别是N2、NO、HCl、CO2、NH3五种中的一种。A能使湿润的红色石蕊试纸变蓝; A与B相遇,有白烟产生;C接触空气立即变成红棕色。由此判断:
A是 (填化学式,下同),B是 ,C是 。
28、(3分)已知某反应在催化剂作用下按以下两步进行:
第一步:X+Y=Z 第二步:Y+Z=M+N+X
(1)此反应的总反应式为
(2)反应的中间产物是 (3)反应的催化剂是
29.(8分) 现有S2-、NH4+、Na+、SO42-、HCO3-等离子,请按要求填空:
⑴在溶液中,只能水解且呈碱性的离子是: ;水解的离子方程式为 。
⑵在溶液中,只能水解呈酸性的离子是: ;水解的离子方程式为 。
⑶既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子是:
⑷既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子是: 该离子分别与强酸、强碱反应的离子方程式为 ;
30、(3分) 在![]() 溶液中,分别加入少量下列物质,把溶液中
溶液中,分别加入少量下列物质,把溶液中![]() 的变化填入下表中(填:增大、减小、不变)。
的变化填入下表中(填:增大、减小、不变)。
| 加入物质 | 通入 | 加少量 | 加少量 |
|
|
31.(6分)可逆反应2Cl2(g)+2H2O(g)![]() 4HCl(g)+O2(g);
ΔH<O.在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g);
ΔH<O.在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
⑴降低温度,Cl2的转化率_______ ___;v正______ ____;
⑵保持容器体积不变,加入He,则HCl的物质的量______ ____。
⑶保持容器压强不变,加入He,则O2的体积分数______ ____;
⑷若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度______ __,相对分子质量________ ____。
32.(共4分)今有a:CH3COOH、b:HCl、c:H2SO4、三种溶液。
(1)当它们的pH相同时,其物质的量浓度的关系是:_____ __。
(2)当它们的物质的量浓度相同时,其pH关系是:_______ __。
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是:_____ __。
(4)体积浓度相同的a、b、c三溶液,分别与同浓度的NaOH溶液反应使pH等于7,所需NaOH溶液的体积关系是:______ _。
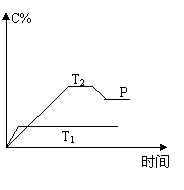 33、(5分)在一定条件下,可逆反应A + B
33、(5分)在一定条件下,可逆反应A + B![]() mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴温度T1 T2(填“大于”、“等于”或“小于”)
⑵正反应是 反应(填“吸热”或“放热”)
⑶如果A、B、C均为气体,则m 2(填“大于”、“等于”或“小于”)
⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体.则体系的压强 (填“增大、“减小”或“不变”),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
三、 实验题(本题包括2小题,共27分)
34.(5分)2NO2(g)![]() N2O4(g)(正反应放热),其中NO2的颜色是
N2O4(g)(正反应放热),其中NO2的颜色是
把装有NO2和N2O4混合气体的装置放入冷水中,看到的现象是
该实验说明了 ;将二氧化氮和四氧化二氮的混合气体装入端口封闭的注射器中,向内迅速推动活塞后保持体积不变,一段时间,观察到的颜色变化是________ ____该实验说明了 ;
35、(22分)阅读下列实验内容,根据题目要求回答问题。
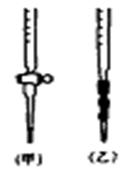 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作
①该滴定操作中应选用的指示剂是 ;
②用用标准0.14mol·L-1 NaOH溶液滴定待测硫酸溶液时,左手把握碱式滴定管的橡皮头,右手摇动锥形瓶,眼睛注视 。直到因加入一滴NaOH溶液,溶液的颜色由 ,半分钟不复色,立即停止滴定。
(2)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
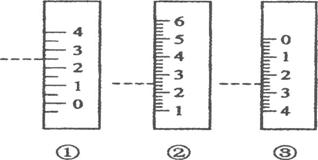
(6)下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是
A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5mL
C.③是滴定管,读数为3.5mL D.②是温度计,读数是2.5℃
(7) 进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
(8)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
四、计算题:(本题包括2小题,共8分)
36.(4分)将6molH2 和3molCO冲入容积为0.5L的密闭容器中,进行如下
![]() 2H2(g)+CO(g) CH3OH(g)6秒后体系达平衡,此时容器压强为开始时的0.6倍。试求:
2H2(g)+CO(g) CH3OH(g)6秒后体系达平衡,此时容器压强为开始时的0.6倍。试求:
①反应达到平衡时,混合气体总物质的量n(平衡)是多少?
②用氢气来表示该反应的平均速率υ(H2) 是多少?
③CO的转化率为α(CO) 为多少?
37.(4分)常温下,0.05mol/L的Ba(OH)2溶液的PH值为多少?取此溶液20 mL,向其中加入0.1mol/L的H2S04溶液,当恰好完全中和时,消耗H2SO4溶液的体积为多少mL。
化学试题参考答案 第一卷答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | C | A | B | B | D | A | D | A | C | B | C | B |
| 题号 | 114 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | # |
| 答案 | B | A | C | C | A | B | D | C | C | D | B | B | # |
二、填空题(每空1分)
26、② ① ③
27、NH3 、HCl、 NO、
28、(1)![]() (2)Z (3)X
(2)Z (3)X
29 (1)S2- 、S2- + H2O === HS- + OH-
(2)NH4+
、NH4+
+ H2O ![]()
![]() NH3·H2O +H+
NH3·H2O +H+
(3)Na+、SO42-、
(4)HCO3-、HCO3-+ H+ === CO2 ↑+ H2O;、HCO3-+ OH- === CO32- + H2O
30、减小, 增大 减小、
31、.(1)减小, 减小(2)不变(3)增大(4)不变, 减小
32. (1)a>b>c (或a>b=2c ) (2)a>b>c (3)a=b>c (4)c>b>a
33、.⑴大于 (2)放热 (3)大于 (4)增大 不
三、实验题
34、(每空1分)红棕色、红棕色变浅、温度降低,化学平衡向放热方向移动;气体颜色先变深,后变浅,但比原平衡时颜色深。增大压强,平衡向体积减小的方向移动。
35.(每空2分)(1)①酚酞;②锥形瓶中溶液颜色变化;无色变红色(或粉红色);
(2)100.00mL容量瓶
(3)0.1mol/L;溶液浓度越稀,误差就越小
(4)乙 (5)偏小 (6)B (7)D (8)4.20mol/L
四、计算题:36、①反应达到平衡时,混合气体总物质的量,n(平衡)=5.4mol;
②用氢气来表示该反应的平均速率υ(H2) = 1.2 mol/(L•s);
③CO的转化率为α(CO) =60﹪。
37、PH=13 ;V=10ml