高二化学第一学期期中检测试题
高二化学(理)
总分100分 考试时间100分钟
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 分数 |
第I卷(共50分)
可能用到的相对原子量:H:1、 O:16、 C:12、 S:32、 Cl:35.5、 Na:23、
Mg:24、 Al:27、 N:14、 Ca:40 Cu:64
| 得分 | 评卷人 |
|
|
|
一、选择题(每小题只有一个选项符合题意,共25个小题,每小题2分,共50分)
1. 下列关于氮族元素的叙述不正确的是( )
A. 氮族元素都属于ⅤA族元素
B.通常都能和氢气直接化合生成稳定的氢化物
C. 单质的氧化性随核电荷数的增加逐渐减弱
D.随着原子序数递增,元素最高价氧化物的水化物的酸性减弱,碱性增强
2、光化学烟雾是一次污染物(如氮氧化物、碳氢化合物等)发生光化学反应后生成的二次污染物,主要含有臭氧、过氧乙酰硝酸酯(CH3—COONO2)等。有关光化学烟雾的说法中不正确的是( )
A.光化学烟雾具有强氧化性
B.汽车尾气是造成光化学烟雾的最主要的原因
C.光化学烟雾对人体没有危害
D.光化学烟雾一般出现在强日照和低湿度、气温较高的条件下
3、下列各组离子在酸性溶液中由于发生氧化还原反应而不能大量共存的是( )
A.Na+、S2-、SO42-、SO32- B.Mg2+、Na+、Cl-、NO3-
C.Cl-、SO42-、Na+、Mg2+ D.K+、HCO3-、S2-、Na+
4、鉴别NO2气体和Br2蒸气,可用( )
A.湿润的淀粉KI试纸 B.AgNO3溶液 C.NaOH溶液 D.NaI溶液
5.将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是( )
(A)v(H2)=0.3 mol·L-1·min-1 (B)H2的转化率为25%
(C)NH3的物质的量浓度为0.8mol·L-1 (D)NH3的体积分数为19.05%
6.体积相同、溶质物质的量浓度也相同的HCl溶液和CH3COOH溶液,分别与NaOH溶液完全中和时,两者消耗NaOH的物质的量( )
A.相同 B.HCl多
C.CH3COOH多 D.无法比较
7.室温下,在PH=12的碱溶液中,由水电离的c(H+)为( )
A. 1.0×10-12 mol·L-1 B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1 D. 1.0×10-7 mol·L-1
8.下列操作中,能使电离平衡H2O![]() H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )
(A)向水中加入NaHSO4溶液 (B)向水中加入Al2(SO4)3溶液
(C)向水中加入Na2CO3溶液 (D)将水加热到100℃,使pH=6
9、在室温下,0.1mol/L 100ml的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A 加入少量CH3COONa固体 B 通入少量氯化氢气体
C 提高温度 D 加入少量纯醋酸
10、下列除杂质(括号内为杂质)操作正确的是( )
A.NO(NO2) ,用NaOH溶液 B.N2(O2),通过灼热的CuO
C.NaCl(NH4Cl),加热 D.红磷(白磷),用H2O溶解过滤
11、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加适量的( )
①NaOH(s) ②NH4Cl(s) ③H2O ④CH3COONa(s)
A.①③ B.②④ C.③④ D.②④
12、往KNO3、FeCl2混合溶液中,逐滴加入稀硫酸时,溶液颜色的变化是( )
A.变成黄色 B.变为深绿色
C.几乎没有变化 D.逐渐变浅
13、HClO是比H2CO3还弱的酸。反应Cl2+H2O===HClO+HCl达到平衡时需要HClO浓度增大(制浓HClO),可加入( )
A.H2S B.CaCO3 C. HCl D.NaOH
14、0.1 mol·L-1NaOH和0.1 mol·L-1NH4Cl溶液等体积混合后,离子浓度大小正确的次序是( )
A. C(Na+)>C(Cl-)>C(OH-)>C(H+)
B. C(Na+)=C(Cl-)>C(OH-)>C(H+)
C. C(Na+)=C(Cl-)>C(H+)>C(OH-)
D. C(Cl-)>C(Na+)> C(OH-)>C(H+)
15、在一密闭容器中反应aA(g)===bB(g)平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则( )
①平衡后向正反应方向进行 ②物质A的转化率减少了
③物质B的质量分数增加了 ④a>b ⑤物质A的转化率不变
A.①② B.①③ C.①④ D.②⑤
16、中和相同体积,相同PH值的Ba(OH)2、NaOH、NH3·H2O三种溶液所用相同浓度的盐酸的体积分别是V1、V2、V3,则三者关系是( )
A.V1=V2=V3 B. V1>V2>V3
C.V3>V1>V2 D.V1=V2<V3
17、在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g)
![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是( )
(A)容器内压强增大 (B)原平衡不受影响
(C)正反应速率增大 (D)NO浓度降低
18、在密闭容器中通入A、B两种气体,在一定条件下使之发生如下反应:
2A(g)+B(g)===2C(g)(正反应为放热反应),达到平衡后,改变一个条件(x),下列(y)一定符合图中所示变化关系的是( )
①x表示温度,y表示C的质量
![]() ②x表示压强,y表示混合气体的平均相对分子质量 y
②x表示压强,y表示混合气体的平均相对分子质量 y
![]() ③x表示再加入A的质量,y表示C的百分含量
③x表示再加入A的质量,y表示C的百分含量
④x表示再加入A的质量,y表示A的转化率
![]() ⑤x表示再加入A的质量,y表示B的转化率
0
x
⑤x表示再加入A的质量,y表示B的转化率
0
x
⑥x表示温度,y表示B的转化率
A.①③⑤ B.②③⑤ C.③④⑤ D.④⑤⑥
19、常温下下列说法正确的是( )
A.将pH=2的酸溶液稀释10倍,溶液的pH一定变为3
B.将pH=2的盐酸和pH=4的盐酸等体积混合后,溶液的pH变为3
C.将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13
D.将0.005 mol/L的硫酸与pH=12的Ba(OH)2溶液等体积混合后,溶液的pH为7
20、下列离子方程式错误的是( )
![]() A.过量CO2通入石灰水:OH-+CO2 HCO3-
A.过量CO2通入石灰水:OH-+CO2 HCO3-
![]() B.Cl2与H2O反应:
Cl2 + H2O H+ + Cl-+ HClO
B.Cl2与H2O反应:
Cl2 + H2O H+ + Cl-+ HClO
![]() C.氨气通入稀硫酸: NH3 + H+ NH4+
C.氨气通入稀硫酸: NH3 + H+ NH4+
![]() D.Cu与稀硝酸: Cu + NO3-+ 4H+ Cu2+ + NO↑+ 2H2O
D.Cu与稀硝酸: Cu + NO3-+ 4H+ Cu2+ + NO↑+ 2H2O
21、FeCl3与下列物质的反应,其中与水解有关的是( )
①紫色石蕊试液②小苏打溶液③铜粉④硫氰化钾⑤氢硫酸⑥碘化钾⑦煮沸的蒸馏水
A.①②⑦ B.④③⑤⑥⑧
C.①⑦ D.①②④⑤⑦
22、氢化铵(NH4H)与NH4Cl结构相似,它与H2O反应有H2生成,下列叙述不正确的是( )
A.NH4H中的H-离子半径比氢原子半径小。
B.NH4H与少量H2O反应产生两种气体。
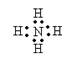
![]() C.NH4H的电子式为[
]+ [ H]-
C.NH4H的电子式为[
]+ [ H]-
D.NH4H溶于H2O所得溶液显碱性。
23、离子AO4x-与S2-在酸性溶液中发生反应:aAO4x-+bS2-+cH+=dA2++eS↓+fH2O,
若b=5,d=2,则AO4x-中的x为( )
A.3 B.7 C.2 D.1
24、相同状况下,容积相同的三个烧瓶中分别充满干燥的NH3、HCl、NO2气体,用水做喷泉实验,烧瓶内三种溶液物质的量浓度之比为( )
A.1:1:3 B.1:1:1 C.2:2:3 D.3:3:2
25、Cu、Mg合金4.6g完全溶于浓硝酸,若反应中硝酸被还原产生4.48 L NO2和0.336L N2O4气体(均为标准状况),在反应后的溶液中,加入足量NaOH溶液,生成沉淀的质量为( )
A.7.04g B.8.26g C.8.51g D.9.02g
第Ⅱ卷(共50分)
二、填空题(本题包含3个小题,共16 分)
26、(4分)完成配平下列化学方程式并回答问题。
Pt + HNO3 + HCl = H2PtCl6
+ NO↑+
其中氧化剂为:______________,电子转移总数为:_______________
27、(6分)有等物质的量的A、B、C、D四种物质混合,发生如下反应:
aA+bB ![]() cC+Dd
cC+Dd
已知生成物C固体,当反应进行一段时间后,测得A减少了n mol ,B减少了n∕2 mol ,C增加了3n∕2 mol,D增加了n mol,此时反应达到化学平衡。
(1)该反应的化学方程式中各物质的化学计量数是:
a= , b= , c= , d= .
(2)如果只改变压强,反应速率发生改变,但反应不移动,则反应中各物质的聚集状态是:A ,B ,D 。
(3)如果只升高温度,反应一段时间后,测知这四种物质的物质的量相等,则该反应的正反应是 热反应。
28、(6分)⑴在25℃时,1mol/L的 ①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2Fe(SO4)2 溶液中,c(NH4+)由小到大的顺序是_____________________________(填写序号)。
⑵用物质的量都是0.1mol的CH3COOH和CH3COONa在常温下配成1L混合溶液,已知其中的c(CH3COO-)>c(Na+),则对该混合溶液的下列判断中正确的是:( )
①c(H+)>c(OH_) ②c(CH3COO-)+ c(CH3COOH)=0.2mol/L
③c(CH3COO-)< c(CH3COOH) ④c(CH3COOH) +c(OH_)=0.1mol/L
A.只有② B ①和② C ①②③ D全部正确
(3)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:
溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是______和_______;
三、推断题(本题包含1个小题,共10 分)
29、下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石芯试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
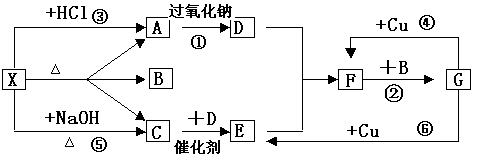 |
⑴化学式:X ,C ,F ,G 。
⑵反应④的化学方程式是: ;
⑶C和D反应的化学方程式: ;
⑷反应⑤的化学方程式是: ;
四、实验题(本题包含1个小题,共14分)
30、(14分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
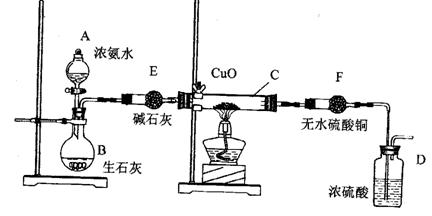
(1)写出烧瓶B中发生反应制氨气的化学方程式:
用平衡移动原理解释能用此法制取氨气的原因:
(2) 本实验进行一段时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:_______________ __,这个反应说明氨气具有______________(填编号:A、碱性 ;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶D中盛浓硫酸的主要作用是 ________ _________。
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置F的作用是____ _______________。
五、计算题(本题包含2个小题,共 10 分)
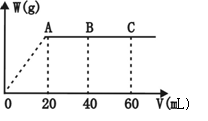
31、(6分)有H2SO4和HCl的混合溶液20mL,加入0.025mol·L-1Ba(OH)2溶液时,生成沉淀的质量wg和Ba(OH)2溶液的体积VmL的关系如图所示(C点混合液PH=7),求:
(1)原混合液中H2SO4和HCl的物质的量浓度?
(2)A点时溶液的PH?(溶液混合时体积变化忽略不计,PH可保留对数形式)
 |
32、(4分)将14g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原合溶液质量增加8g,则(1)产生的NO气在标准状况下的体积 升。
(2)原溶液中硝酸的浓度为 mol·L-1 。(此题不要解题过程)
高二化学试题答案(理)
一、选择题(每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | A | B | B | A | A | B | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | B | B | B | D | D | B | D | D |
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 答案 | A | A | D | B | C |
二、填空题(本题包含3个小题,共 16 分)
26、(共4分)
3、4、18、3、4、8 H2O (2分) HNO3 、12e- (2分)
27、(共6分)
(1)2、1、3、2 (2分)(2)气体,固体或液体,气体。(2分)
(3)放(2分)
28、(共6分)
(1) ②<①<③ (2分) (2) B (2分) (3) CH3COO- 和 CH3COOH (2分)
三、推断题(本题10 分)
29、⑴ NH4HCO3 、NH3 、NO2 、HNO3 。(4分)
|
|
|
⑷NH4HCO3+NaOH = NaCl+NH3↑+H2O↑(各2分)
四、实验题(本题包含2个小题,共14分)
30、 (1)NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2 (2分)
![]()
![]() 氨水中存在NH3+H2O NH3·H2O
NH4+ + OH― 平衡,生石灰与水反应产生
氨水中存在NH3+H2O NH3·H2O
NH4+ + OH― 平衡,生石灰与水反应产生
OH―且 放热使平衡左移,促进了氨的挥发。 (2分)
|
(2)2NH3+3CuO= N2+3Cu+3H2O (2分) B (2分)
(3)干燥N2 ,除去过量NH3 (2分) (4) C (2分)
(5)检验C处反应 有无H2O的产生 (2分)
五、计算题(本题包含2个小题,共 10 分)
31.(6分)(1)A点:0.025×20×10-3=C(H2SO4)×20×10-3
C(H2SO4)= 0.025mol·L-1(2分)
C点:0.025×60×10-3×2=[0.025×2+C(HCl)]×20×10-3
C(HCl)=0.1mol·L-1(2分)
(2)A点n(OH-)=0.025×2×20×10-3mol n(H+)=(0.025×2+0.1) ×20×10-3mol
C(H+)=![]() =0.05mol·L-1 PH=2-lg5=1.30 (2分)
=0.05mol·L-1 PH=2-lg5=1.30 (2分)
32、(共4分) (1)4.48 (2)0.8 (各2分)