高二化学第一学期期中考试
高二化学
命题人:
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共8页,三道大题,
满分值:100分,考试时间:90分钟。考生只交第Ⅰ卷的答题卡和第Ⅱ卷。
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64
可能用到的数据:lg2=0.3 lg5=0.7
第Ⅰ卷(选择题 共54分 请将答案填涂在答题卡上)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.下列各种试纸,在使用时预先不能用蒸馏水润湿的是( )
A.红色石蕊试纸 B.蓝色石蕊试纸 C.碘化钾淀粉试纸 D.PH试纸
2.在下列过程中,需要加快化学反应速率的是( )
A、钢铁腐蚀 B、食物腐败 C、炼钢 D、塑料老化
![]() 3.对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
3.对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O )= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1
4.已知热化学反应方程式:
Zn(s)+ ![]() O2(g)
O2(g)![]() ZnO(s);ΔH=-351.5
kJ·mol-1
ZnO(s);ΔH=-351.5
kJ·mol-1
Hg(l)+ ![]() O2(g)
O2(g)
![]() HgO(s);ΔH=-90.84
kJ·mol-1
HgO(s);ΔH=-90.84
kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s) = ZnO(s)+Hg(l)的ΔH为( )
A. ΔH = +260.7 kJ·mol-1 B. ΔH = -260.7 kJ·mol-1
C. ΔH = -444.2 kJ·mol-1 D. ΔH = +444.2 kJ·mol-1
5. 现在探索的新能源有:①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气 ( )
A、②③⑥⑦ B、①④⑤ C、③⑥⑦⑧ D 、①②④
6.夏天,因鸡没有汗腺只能依赖“喘息”调节体温,鸡过度的呼出CO2,使下列平衡向左移动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。
CO2(g) ![]() CO2(aq)
CO2(aq) + H2O
CO2(aq)
CO2(aq) + H2O![]() H2CO3(aq)
H2CO3(aq)
H2CO3(aq)
![]() H+(aq)+ HCO3- (aq) HCO3-
H+(aq)+ HCO3- (aq) HCO3- ![]() H+(aq)+
CO32-(aq)
H+(aq)+
CO32-(aq)
Ca2+(aq)+CO32-(aq)== CaCO3(s)(蛋壳中)
澳大利亚学者研究发现,夏季给鸡适当喂食下列某种饮料会使蛋壳变厚,这种饮料是( )
A.淡盐水 B. 黄酒 C.食醋 D. 澄清石灰水
7. 以下反应不可以用熵判据来解释的是( )
A.硝酸铵自发地溶于水
B. CaCO3(s) == CaO(s)+CO2(g) △H= +175.7kJ/mol
C.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H= +74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l) △H= -285.8kJ/mol
8下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水 ②取一定体积的待测液于锥形瓶中
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
A. ①③②④⑤⑥ B. ①⑤③④②⑥
C. ②③①④⑤⑥ D. ④⑤①②③⑥
9. 若溶液中由水电离产生的H+的浓度为1×10-13mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
10.下列事实可证明氨水是弱碱的是( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.0.1mol/L氯化铵溶液的pH约为5
11.在一定温度不同压强(P1<P2)下,可逆反应2X(g) ![]() 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(w)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(w)与反应时间(t)的关系有以下图示,正确的是( )
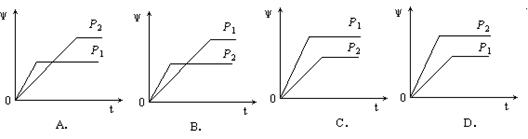
12. 工业上生产苯乙烯是利用乙苯在560℃时的脱氢反应:
C8H10 (g) ![]() C8H8(g) + H2(g)
C8H8(g) + H2(g)
针对上述反应,有人提出如下观点,其中合理的是:( )
A.在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率
C.在乙苯反应达到平衡过程中,体系的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件
13. 在25℃,将pH=11的NaOH溶液a mL与pH=1的H2SO4溶液b mL混合,当恰好完全中和时,a与b的比值( )
A.1000:1 B.100:1 C.50: 1 D.10: 1
14下列热化学方程式中的反应热表示燃烧热的是( )
A.C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l);ΔH= - akJ·mol-1
6CO2(g)+6H2O(l);ΔH= - akJ·mol-1
B.CH3CH2OH(l)+ ![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l);ΔH= -bkJ·mol-1
CH3CHO(l)+H2O(l);ΔH= -bkJ·mol-1
C. 2CO(g)+ O2(g)![]() 2
CO2(g);ΔH= - c kJ·mol-1
2
CO2(g);ΔH= - c kJ·mol-1
D.NH3(g)+ ![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+ ![]() H2O(g);ΔH= - d kJ·mol-1
H2O(g);ΔH= - d kJ·mol-1
15. 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)![]() Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是( )
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
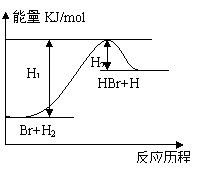 16.参照反应Br+H2 →HBr+H的能量对反应历程的示意图,
16.参照反应Br+H2 →HBr+H的能量对反应历程的示意图,
下列叙述中正确的是( )
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂可降低正反应速率,增大逆反应速率
D.加入催化剂可增大正反应速率,降低逆反应速率
17. 等体积、等浓度的BOH溶液与HA溶液混合后,
溶液中有关离子浓度一定不可能存在的关系是( )
A.C(B+)> C(A-) > C(OH-) > C(H+) B.C(B+)> C(A-) > C(H+) > C(OH-)
C.C(A-)> C(B+)> C(H+) > C(OH-) D. C(B+)+ C(H+) =C(A-)+C(OH-)
18.常温下,某溶液中水电离出的c(H+)=10-5mol·L-1,该溶液中溶质可能是( )
①NaOH②CH3COOH ③AlCl3 ④HCl ⑤Na2CO3 ⑥CuSO4 ⑦Na2SO4 ⑧KCl
A. ② ④ ③ B. ③ ⑥ C.①⑤ D. ⑦ ⑧
第Ⅱ卷(非选择题)(共46分)
二. 填空题
19.(5分)用离子方程式解释下列事实
(1)可用纯碱溶液清洗油腻的碗筷,原因是
_____________________________________________________________________
(2)用热水配制CuCl2溶液,溶液会出现浑浊,原因是
_____________________________________________________________________,
因此,配制CuCl2溶液时应加入少量的_________(试剂)
20.(2分)25℃时pH=3的盐酸与pH=5的硫酸等体积混合后,pH= ______________
21. (4分)已知某温度下,Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1
(1)物质的量浓度均为0.1 mol·L-1的HCN、HF、CH3COOH、 HNO2溶液中,
PH最小的是_______________
(2)物质的量浓度均为0.1 mol·L-1的NaCN、NaF、CH3COONa、 NaNO2溶液中,
PH最小的是_______________
22(8分)合成氨反应在工业生产中的大量应用,满足了人口的急剧增长对粮食的需求,也为有机合成提供了足够的原料—氨。合成氨是一个可逆反应:
N2(g)+3H2(g) ![]() 2NH3(g)。在298K时,△H= -92.2KJ.mol-1, KP= 6.6×106
2NH3(g)。在298K时,△H= -92.2KJ.mol-1, KP= 6.6×106
(1)从平衡常数来看,反应的限度已很大了,为什么还需要使用催化剂?
______________________________________________________________________
(2)某温度下,向1L密闭容器中加1molN2和3molH2,使之反应合成NH3,达到平衡后测得NH3的体积分数为75%,求该温度下的平衡常数K=___________;
若保持温度、压强不变,向该容器中加入0.75mol的N2,Xmol的H2,Ymol的NH3,达到平衡时,NH3的体积分数仍为75%,求X=___________mol, Y=____________mol
三. 实验题
23(14分)草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:
①称取wg草酸晶体配成100.0mL水溶液;
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol/LKMnO4
滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为配制准确浓度的草酸溶液,所需用到的仪器是:
天平(含砝码)、烧杯、药匙和 _________
(2)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管或碱式滴定管)
(3) 滴定中,目光应注视 _____________________ _
判断滴定结束的标准是 ___________________
(4)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 ,由此计算出草酸晶体的X值是
____________________________________________________ _
(5)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的草酸溶液的物质的量浓度_____(偏大或偏小)
24(13分)某同学利用如图所示的装置进行中和热测定的实验,实验步骤如下:
①在大烧杯底部垫碎泡沫塑料,放入小烧杯,
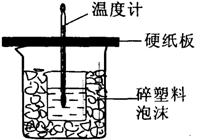 再在大、小烧杯之间填上碎纸条,
再在大、小烧杯之间填上碎纸条,
大烧杯上用硬纸板作盖板
②用一个量筒取50mL2.0 mol·L-1盐酸,
倒入小烧杯中,并用温度计测量盐酸的温度,
然后把温度计上的酸用水冲洗干净
③用另一个量筒取50mL2.0 mol·L-1NaOH溶液,
并用温度计测量NaOH溶液的温度
④把套有盖板的温度计放入小烧杯的盐酸中,并将量筒中的NaOH溶液缓缓倒入小烧
杯中(注意不要洒在外面),盖好盖板。用温度计轻轻搅动溶液(注意不要碰到烧杯底部或烧杯壁),并准确读取混合溶液的最高温度,记为终止温度
⑤________________________________________________________________________
⑥根据实验数据计算中和热
回答下列问题:
(1)请将上面第⑤步的实验步骤补充完整
(2)从实验装置上看,图中尚缺少的一种玻璃仪器是(量筒除外)__________________
(3)为保证该实验成功采取了许多措施,其中最主要的作用在于____________________
(4)在以上①--④步操作或装置图中,有许多不当之处,请一一指出(可不填满,也可补充)
I ______________________________________________________________________
II______________________________________________________________________
III_____________________________________________________________________
IV______________________________________________________________________
V______________________________________________________________________
VI_____________________________________________________________________
(5) 用正确的方法测得含有11.2克KOH的稀溶液与1L0.1 mol·L-1的H2SO4溶液反应,
放出11.46KJ热量,该反应的中和热化学方程式是
_______________________________________________________________________
高二化学答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | A | B | B | D | D | B | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 答案 | B | B | B | A | D | B | B | B |
19 (1)CO32- + H2O
![]() HCO3 - +
OH – (2分)
HCO3 - +
OH – (2分)
(2) Cu2+ + 2H2O ![]() Cu(OH)2
+2H+ (2分) 盐酸(1分)
Cu(OH)2
+2H+ (2分) 盐酸(1分)
20 3.3 (2分)
21 (1)HF (2)NaF (各2分)
22 (1)加快反应速度提高效率
(2)261.3
(3)X=2.25 mol Y=0.5mol (各2分)
23 (1)玻璃棒、100mL容量瓶、胶头滴管 (2分)
(2)酸式滴定管(2分)
(3)锥形瓶中溶液颜色的变化;(2分)
待测液刚好出现紫色且半分钟内不褪色(2分)
(4)![]() (各2分)
(各2分)
(5)偏小(2分)
24 (1)重复实验两次,取测量所得数据的平均值作为计算依据 (2分)
(2)环形玻璃搅拌器 (2分)
(3)减少热损失 (2分)
(4)小烧杯杯口与大烧杯杯口没有相平;
盐酸浓度大了;
NaOH浓度大了;
量筒中的NaOH溶液缓缓倒入小烧杯中;
用温度计轻轻搅动溶液
(答出一点给1分)
(5)KOH(aq) +![]() H2SO4(aq)==K2SO4(aq) + H2O(l)
ΔH= - 57.3kJ·mol-1
H2SO4(aq)==K2SO4(aq) + H2O(l)
ΔH= - 57.3kJ·mol-1
(2