高二化学上期第二次月考试卷
高 二 化 学
命题人:陈景森
1、本试卷分试题卷和答题卷,满分100分,考试时间 90分钟;
2、答题前,在答题卷密封区内及答题卡上填涂班级、姓名和考号;
3、选择题答案必须用2B铅笔涂在答题卡上,其余答案写在答卷上,写在试卷上无效;
4、考试结束,只需交答题卷。
5、可能用到的相对原子质量:
H-1,C-12,N-14,O-16,Na—23,Mg—24,Al-27,Fe-56,Cu-64,
Zn-65。
第Ⅰ卷(共48分)
一、选择题(共12小题,每小题2分,每小题只有一个答案符合题意)
1.常温下某溶液中由水电离的c(H+)=10—10mol·L—1,该溶液中溶质不可能是( )
A.NaHSO4 B.Al2(SO4)3 C.NH3·H2O D.HCl
2.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.用铝热法还原下列化合物,制得金属各1mol,消耗铝最少的是( )
A.Fe3O4 B.MnO2 C. WO3 D.Cr2O3
4.镁粉在焰火、闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,
下列可作为镁蒸气的冷却气体的是 ( )
(1)空气 (2)C02 (3)Ar (4)H2 (5)N2
A.(1)(2) B.(2)(3) C.(3)(4) D.(4)(5)
5. 下列不能由单质直接化合而得到的化合物是( )
A. FeCl2 B. Al2S3 C. FeS D. Fe3O4
6.下列各物质的水溶液,滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是
A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.KOH
7.下列方法能使电离平衡![]()
![]()
![]() 向右移动,且使溶液呈酸性的( )
向右移动,且使溶液呈酸性的( )
A.向水中加入少量硫酸氢钠固体
B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体
D.将水加热到100℃,使水的pH=6
8.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg![]() .下列叙述正确的是
( )
.下列叙述正确的是
( )
① 任何温度下,水的AG等于0 ② 溶液的AG越小,酸性越强
|
A.①③ B.②④ C.①② D.③④
9.已知Cl2、Al2S3、CaC2、C2H5Br、CH3COOCH3等物质的均能与水发生反应,反应可视为各物质和水均分别离解成两部分,然后再两两重新组合,形成新的物质。下列化学反应符合这一特点的是 ( )
① ICl+H2O→HIO+HCl ② Al4C3+12H2O→3CH4↑+4Al(OH)3↓
③ CaC2+2H2O→Ca(OH)2+C2H2↑ ④ Mg3N2+6H2O→3Mg(OH)2↓+2NH3↑
⑤ SiCl4+4H2O→H4SiO4↓+4HCl
A.只有①④⑤ B.只有②③⑤ C.只有①②③④ D.①②③④⑤
10.如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是 ( )
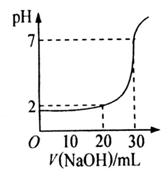 |
A | B | C | D | |
|
| 0.12 | 0.04 | 0.03 | 0.09 |
|
| 0.04 | 0.12 | 0.09 | 0.03 |
![]() 11.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
11.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
12.某溶液中加入铝粉能产生氢气,则该溶液中肯定不能大量共存的离子组是
A.NH4+、NO3-、Cl—、Na+ B.Na+、 Al3+、H+、Cl-
C.NO3-、Ba2+、K+、Cl- D.NO3-、K+、AlO2-、OH-
二、选择题(共8小题,每小题3分,每小题只有一个答案符合题意)
13.用0.01mol / L NaOH溶液完全中和pH=3的下列溶液各100mL,需NaOH溶液体积最大的是 ( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
14.Na、Mg、Al、Fe四种金属中两种组成的混合物12g,与足量盐酸反应放出H2 0.5g,则混合物中必定含有的金属是 ( )
A.Na B.Mg C.Al D.Fe
15.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是 ( )
A.![]() 的电离方程式:
的电离方程式:![]()
![]()
![]()
B.![]() 离子的水解方程式:
离子的水解方程式:![]()
![]()
![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
16.用含amolAlCl3的溶液和含bmolNaOH的溶液混和,可得沉淀的物质的量为
|
A.①② B.①④⑤ C.①③④⑤⑦ D.①③④⑥⑦
17.下列各溶液中,微粒物质的量浓度关系正确的是 ( )
A.![]() 溶液中: [OH—]=[HCO3—]+[H+]>[CO3—]
溶液中: [OH—]=[HCO3—]+[H+]>[CO3—]
B.![]() 溶液中:
溶液中: ![]()
C.![]() 溶液中:
溶液中: ![]()
D.![]() 溶液中:
溶液中: ![]()
18.在VL Al2(SO4)3 溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体m g,溶液中SO42―的物质的量浓度是( )
A. m / 27V mol·L-1 B. 2m / 27V mol·L-1
C. 3m/54V mol·L-1 D. 3m/102V mol·L-1
19.甲乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为( )
A. 5.4g B. 3.6g C. 2.7g D. 1.8g
20.常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11∶1 B.10∶1 C.6∶1 D.5∶1
第Ⅱ卷(共52分)
 三、填空题(52分)
三、填空题(52分)
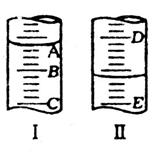
21.(2分)图I表示10mL量筒中液面的位置,
A与B,B与C刻度相差1mL,
如果刻度A为6,量筒中液体的体积是 mL。
图II表示50mL滴定管中液面的位置,如果液面处的
读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL
C.一定大于a D.一定大于(50-a)mL
22.(11分)工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拦,使之溶解,得一强酸性的混合溶液,现欲从该该混合溶液中制备纯净的CuCl2溶液,采用以下步骤 [参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
|
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A.NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
23.(4分)实验室配制硝酸汞溶液时,须将其晶体溶于稀硝酸中,其目的是 ,所涉及反应的离子方程式为 。
24.(5分)有A.B.C.D.E均为含铝元素的化合物。F是一种气体,此气体对氢气的相对密度为为17。有下列反应.
①A + NaOH → D + H2O ②B ![]() A + H2O
A + H2O
③C + NaOH(适量)→B + NaCl, ④E + H2O →B + F。
则E的化学式为 ,
反应①的化学方程式__ _ _。 实验室制B的离子方程式为_________ 。
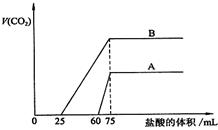
|
和B,每份50mL,向其中各通入一定量的CO2,然
后各取溶液10mL,分别将其稀释为100 mL,分别
向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标
准状况下产生CO2气体体积与所加盐酸体积之间的
关系如下图所示,试回答下列问题:
(1) 曲线A表明,原溶液中通入CO2后,所得溶
液中的溶质为(写化学式) ,两
种溶质的物质的量之比为 ;加盐酸后
产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
26.(16分)向含b摩尔AlCl3溶液中逐滴加入含a摩尔NaOH溶液。试回答:
⑴ 依次写出溶液中发生反应的化学方程式:
⑵若 a+b =1 摩尔,当a取不同值时,含Al元素的生成物可能有如下情况:
(Ⅰ)全部是Al(OH)3 ,a 的取值范围是_______________;
(Ⅱ)全部是NaAlO2 ,a 的取值范围是_____ ______;
(Ⅲ)部分是NaAlO2,部分是Al(OH)3,a 的取值范围是__________________。
反应所生成的Al(OH)3的物质的量为_____________摩尔,反应所生成的各物质的总物质的量(包括水)为_______________摩尔(后两空用含b的式子表示)。
(Ⅳ)在上述条件下,若要生成7.8克沉淀,则 a 的值等于______或_______。
  | |||
| |||
高 二 化 学
三、填空题(52分)
21.(2分) 。
22.(11分)
(1) ,
①
② , ,
。
(2)
23.(4分) ,
。
24.(5分) ,
__ 。
_________ 。
25.(14分)
(1) , ; mL。
(2) , ; mL。
(3) 。
26.(16分)
⑴
⑵
(Ⅰ)_______________;
(Ⅱ)_____ ______;
(Ⅲ)__________________。_____________ _______________
(Ⅳ)______或_______。
|
高二化学参考答案
一、二 选择题(1至12题各2分,13至20题各3分。本题共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | D | C | A | B | B | A | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | D | D | C | C | D | D | A | C |
21.(2分) 每各空1分,共2分
5.8 D
22.(11分) 前五空每空各1分,最后两空各3分,共11分
(1) 不能 因Fe2+沉淀的pH最大,F2+沉淀完全时,Cu2+也沉淀。
① A
② 不妥当 引入了新杂质Na+
③ C、D、E
(2) C、E、F
23.(4分) 每空各2分,共4分
防止Hg2+水解生成沉淀
![]() Hg2+ + 2H2O Hg(OH)2↓+2H+
Hg2+ + 2H2O Hg(OH)2↓+2H+
24.(5分) 第一空1分,其余每空各2分,共5分
Al2S3
Al2O3 +2OH— = 2AlO2— + H2O
Al3++3NH3 ·H2O=Al(OH)3↓+3 NH4+
25.(14分) 每空各2分,共14分
(1) NaOH、Na2CO3 3∶1 33.6
(2)Na2CO3、NaHCO3 1∶1 112
(3)![]()
26.(16分) 每空各2分,共16分
⑴ AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH =NaAlO2+2H2O
⑵
(Ⅰ) 0 < a ≤0.75
(Ⅱ) 1 > a ≥.0.8
(Ⅲ) 0.75 < a <0.8 5b-1 2-4b
(Ⅳ) 0.3 或 0.78