高二化学下册期中考试试题
高二化学试题
第I卷(选择题,共54分)
一、选择题(每小题3分,共24分。每题有一个选项符合题意。)
1、关于原子结构模型的演变过程,正确的是( )
A、汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B、汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C、道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→汤姆逊原子模型→量子力学模型
D、道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
2、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是 ( )
A.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
B.在元素周期表中X位于Y的右面
C.Y的气态氢化物的稳定性小于X的气态氢化物的稳定性
D.X与Y形成的化合物中,X显负价,Y显正价
3、为揭示原子光谱是线状光谱这一事实,玻尔提出了核外电子的分层排布理论,下列说法中,不符合这一理论的是( )
A、电子绕核运动具有特定的半径和能量
B、电子在特定半径的轨道上运动时不辐射能量
C、电子跃迁时,会吸收或放出特定的能量
D、提示了氢原子光谱存在多条谱线
4、已知某原子的各级电离能数值如下:![]()
![]() ,则该原子形成离子的化合价为( )
,则该原子形成离子的化合价为( )
A、+1 B、+2 C、+3 D、+4
5、若将6C原子的电子排布写成了![]() ,它违背了( )
,它违背了( )
A、能量守恒原理 B、能量最低原则
C、洪特规则 D、泡利不相容原理
6、有四个电子层的某一元素原子中未成对电子数最多可达( )
A、4个 B、5个 C、6个 D、7个
7.以下现象与核外电子的跃迁有关的是( )
① 霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光
⑥ 燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
8、已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是( )
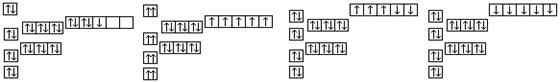 A
B
C
D
A
B
C
D
二、选择题(本题每题3分,共30分。每题有一个或两个选项符合题意。)
9、下列说法中正确的是( )
A、非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B、非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C、最外层有2个电子的原子都是金属原子
D、最外层有5个电子的原子都是非金属原子
10、元素的气态原子在基态时获得一个电子成为一价气态负离子所放出的能量称为电子亲和能,下列元素的原子电子亲和能的比较正确的是( )
A.Na>Mg>Al>Si B.F>Cl>Br>I
C.Rb>K>Na>Li D.C>N>O>F
11、科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法正确的是( )
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子都达8电子稳定结构,化学性质相同
12、超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素![]() X,试根据原子结构理论和元素周期律预测正确的是( )
X,试根据原子结构理论和元素周期律预测正确的是( )
A.![]() X 位于第七周期,第ⅣA族 B.X是非金属元素
X 位于第七周期,第ⅣA族 B.X是非金属元素
C.XO2是酸性氧化物 D.X元素的化合价有+2和+4
13、对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3 B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
14、图1和图2分别是1s电子的概率概率分布图和原子轨道图。下列有关认识正确的是
A.图1中的每个小黑点表示1个电子( )
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈圆形,有无数对称轴
D.图1中的小黑点表示某一时刻,电子在核外所处的位置
15、下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 C.1s22s22p63s23p64s2
16、已知短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,则下列叙述正确的是( )
都具有相同的电子层结构,则下列叙述正确的是( )
A、原子半径:B>A>C>D
B、原子序数:d>c>b>a
C、离子半径:C>D>B>A
D、元素的第一电离能:A>B>D>C
17、下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是( )
A、核内无中子的原子
B、电子构型为3S23P1
C、最外层电子数等于倒数第三层上的电子数的原子
D、N层上无电子,最外层上的电子数等于电子层数的原子
18、人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
一、(本题每小题3分,共24分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
二、(本题每小题3分,共30分,每小题只有一个或两个正确答案)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题,共46分)
三、填空题
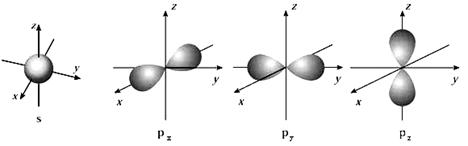 19、(共14′)
⑴下面是s能级和p能级的原子轨道图,试回答问题:
19、(共14′)
⑴下面是s能级和p能级的原子轨道图,试回答问题:
s电子的原子轨道呈 形,每个s能级有 个原子轨道;p电子的原子轨道呈 形,每个p能级有 个原子轨道。
⑵s电子原子轨道、p电子原子轨道的半径与 因素有关。
具体关系是 。
⑶某元素的原子获得能量后的电子排布式为1s2 2s22p6 3s23p3 4s1,则该元素的原子获得能量前的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 。
20、写出下列微粒的电子排布式和轨道表示式。、(共12′)
(1)![]() ______________________,________________
_________;
______________________,________________
_________;
(2)![]() _______________________,__________
_______________;
_______________________,__________
_______________;
(3)![]() _______________________,___________
______________。
_______________________,___________
______________。
四、推断题
21.(共12′)下面是元素周期表的简略框架图。
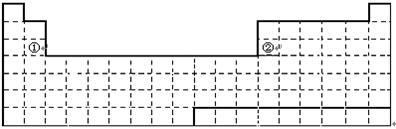
⑴请在上面元素周期表中画出金属元素与非金属元素的分界线。按电子排布,可把元素划分成5个区,不全是金属元素的区为_________________。
⑵根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的___________族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实 。
⑶上表中元素①、②原子的最外层电子的电子排布式分别为: 、___________________;比较元素①与元素②的下列性质(填写“>”或“<”)。原子半径:①_______②、电负性:①_______②、金属性:①_______②。
⑷某短周期元素最高正价为+7,其原子结构示意图为________ ____。
22.(共8′) 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)
所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
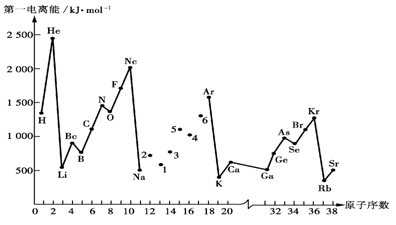
请回答以下问题:
⑴ 认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵ 从上图分析可知,同一主族元素原子的第一电离能I1变化规律是_____ _______
_____________________________;
⑶ 上图中5号元素在周期表中的位置是____________________________;
⑷ 上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
江苏省淮安市范集中学期中考试
高二化学试题 (参考答案)
一、(本题每小题3分,共24分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | A | D | C | C | C | A | D |
二、(本题每小题3分,共30分,每小题只有一个或两个正确答案,漏选得2分多选得0分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | B | C | AD | D | D | A | AC | BD | BD |
三、(共37分)
19.(每空2′,共14′)⑴球,1, 纺锤,3;⑵与能层序数n有关。能层序数n越大,原子轨道的半径越大。⑶1S22S22P63S23P4(或[Ne] 3S23P4)、S、H2SO4 。
20、![]()
|
|
![]()
|
|
|
21.(4小题,共12′)
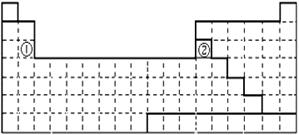 ⑴ (共3′)右表中 s区 和p区
⑴ (共3′)右表中 s区 和p区
(2′);分界线(1′)
 ⑵(共3′) IVA(1′);
H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H(2′)(其他合理答案如与碱金属元素形成离子或化合物M+[∶H]-或NaH的存在等均可);
⑵(共3′) IVA(1′);
H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H(2′)(其他合理答案如与碱金属元素形成离子或化合物M+[∶H]-或NaH的存在等均可);
⑶(每空1′,共5′)3s2、3s23p1;>、<、>。 ⑷ (1′)
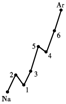
22.(每小题2′,共8′)⑴见右图
⑵从上到下依次减小; ⑶第三周期,ⅤA族;
⑷因同主族上一周期的元素的氢化物分子间存在氢键