高二化学下册测试卷
命题人:许承标
可能用到的相对原子质量有:C —12 H—1 O — 16 Zn—65 Cu—64
一、选择题(每题只有一个答案符合题意 共27×2=54分)
1.2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球—科学发展,构建和谐”。你认为下列行为中不符合这一主题的是:
A、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B、控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
2.生活中的一些问题常涉及到化学知识,下列叙述不正确的是:
A . 糯米中的淀粉发生水解反应,生成乙醇
B . 食醋中的溶质主要成分是醋酸
C. 棉花和人造丝的主要成分都是纤维素
D . 室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
![]() 3.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是:
3.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是:
A. 0.04 B . 0.08 C . 0.02 D . 0.16
4.下列说法不正确的是:
A . 油脂属于高分子化合物 B .天然蛋白质水解的最终产物都是a—氨基酸
C. CuSO4溶液会使蛋白质变性 D . 油脂水解的共同产物是甘油
5.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况),则所消耗的硝酸的物质的量是:
A.0.12mol B.0.11mol C.0.09mol D.0.08mol
6.A、B、C都是金属,把A放入C盐溶液时,A的表面附着一层C;A与B作电极构成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为:
A . A>B>C B. A>C>B C . B>A>C D . B>C>A
7.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是:
A.Cl-、Mg2+、SO![]() 、K+ B.NH
、K+ B.NH![]() 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+ D.HCO
、Na+ D.HCO![]() 、K+、NO
、K+、NO![]() 、SO
、SO![]()
8.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为:
①加入足量氯水 ②加入足量KMnO4酸溶液 ③加少量NH4SCN
A、①③ B、③② C、③① D、①②③
9.2005年美国遭受飓风袭击,整个新奥尔良都浸泡在水中。灾区的灾民欲将海水转化为可饮用水,除了要降低盐分外,还要进行下列处理,其合理的顺序是:
①化学沉降(用明矾)②消毒杀菌(用漂粉精)③自然沉降 ④加热煮沸
A.①②③④ B.③①②④ C.③①④② D.①③④②
10.从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)![]() H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为:
H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为:
A.红色变深 B.黄色变浅 C.黄色变深 D.褪为无色
11.向10mL pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是:
A.弱碱 B.一元强碱 C.多元强碱 D.任何碱
12. 在密闭容器中进行下列反应:M(g)+N(g)
![]() R(g)+2 L(?)此反应符合下面图像。下列叙述正确的是:
R(g)+2 L(?)此反应符合下面图像。下列叙述正确的是:
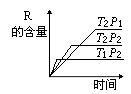 A.正反应吸热,L是气体 B.正反应吸热,L是固体
A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是液体 D.正反应放热,L是气体
13. 25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶
液按体积比1:100混合,反应后所得溶液pH=7。若3x= y,则x值为
A.2 B.3 C.4 D.5
14.在由水电离产生的c(H+)=10-12mol·L-1的溶液中,一定能大量共存的离子组是:
A.NH4+、Ba2+、Cl-、NO3- B.Cl-、SO42-、Na+、K+
C.SO42-、NO3-、Fe2+、Mg2+ D.Na+、K+、ClO-、I-
15. 生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是:
A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰,驱逐O2,稀释可燃气体,分解产物MgO和Al2O3较快地中和塑料燃烧过程中产生的酸性及腐蚀性气体,所以它们可以作为未来发展方向的无机阻燃剂。
B、百事公司的百事可乐和“七喜”、“美年达”等碳酸饮料一个很大的不同是没有添加苯甲酸钠作防腐剂,因为其中含有磷酸,酸性比较强的环境下细菌不容易繁殖;
C、苯酚具有杀菌消毒作用,药皂中常常掺有少量苯酚,所以我们可将苯酚直接涂抹在皮肤上起消毒作用;
D、用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
16. 某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);正反应为放热反应。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g);正反应为放热反应。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
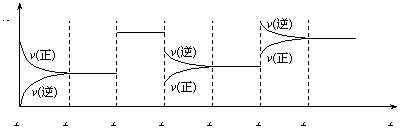 下列说法中正确的是:
下列说法中正确的是:
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t5时降低压强
17. 丙烯酸的结构简式为CH2=CH—COOH,对其性质的描述不正确的是:
A 能与金属钠反应放出氢气 B 不能与新制氢氧化铜反应
C 能发生加聚反应生成高分子化合物 D 能使溴水褪色
18. 相同温度、相同物质的量浓度的下列4种溶液: ① CH3COONa ② NaHSO4 ③ NaCl
④ C6H5ONa,按pH由大到小的顺序排列正确的是:
A.④>①>③>② B.①>④>③>② C.①>②>③>④ D.④>③>①>②
19. 某物质中可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:①有银镜反应 ②加入新制Cu(OH)2悬浊液,沉淀不溶解,③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,下列叙述中正确的是:
A.一定有甲酸乙酯和甲酸 B.一定有甲酸乙酯和乙醇
C.一定有甲酸乙酯,可能有甲醇 D.几种物质都一定有
20. 下列实验的失败是因为缺少必需的实验步骤造成的是:
① 锌与稀硫酸反应制取氢气,用排水法收集不到氢气;② 实验室用无水乙醇和浓硫酸共热140℃制取乙烯时得不到乙烯;③ 验证RX是碘代烷,把RX与NaOH水溶液混合后,加入AgNO3溶液出现褐色沉淀;④ 做醛的还原性实验时,当加入新制的Cu(OH)2悬浊液加热后,未出现红色沉淀;⑤ 检验淀粉己水解,将淀粉与少量稀H2SO4加热一段时间后,加入银氨溶液后未出现银镜
A.③⑤ B.③④⑤ C.①③④⑤ D.①②③④⑤
21. 下列有关物质用途的说法不正确的是:
A.乙烯是一种植物生长调节剂,可用作果实催熟剂 B.聚氯乙烯薄膜可用作食品包装
C.氧炔焰可用来焊接或切割金属 D.石油是各种烷烃、环烷烃、芳香烃的混合物
22. 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度
A.①④ B.②③ C.②③④ D.只有④
23. 下列离子方程式书写正确的是:
A.碳酸钠溶于水:![]()
B.向![]() 粉末中加入足量HI溶液:
粉末中加入足量HI溶液:![]()
C.向![]() 溶液中加入过量盐酸:
溶液中加入过量盐酸:![]()
D.将Mg粉加入![]() 溶液中:
溶液中:![]()
24. 将等物质的量的镁和铝相混合,平均分成4份,分别加到足量的下列溶液各100 mL中,充分反应后,放出氢气最多的是:
A. 3 mol·L-1 HCl B. 4 mol·L-1 HNO3 C. 8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
25. 在某稀硝酸溶液中加5.6g铁粉全部溶解,放出NO气体,溶液质量增重3.2g,所得溶液中Fe2+和Fe3+的物质的量之比是:
A . 1︰1 B . 2︰1 C. 3︰2 D . 4︰1
26.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是:
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
27. 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法正确的是:
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液呈酸性,则一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若溶液呈碱性,则一定满足:c(NH4+)>c(Cl-)
D.若溶液呈中性,则一定满足:c(NH4+)>c(Cl-)
二、填空题(本大题包括5小题,共32分)
28、(4分)在2L的密闭容器中,加入2mol A和1mol B,发生下述反应:2A(g)+B(g)![]() 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
⑴温度不变,若缩小容器的体积,则平衡_______移动(填正向、逆向或不)
⑵维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是________。
A.4molA+2molB B.2molC+1molD
C.2molA+1molB+2molC+1molD D.1molA+0.5molB+1molC+0.2molD
29、(4分)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
30、(6分)已知在同一碳原子上连有两个羟其的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
 |
⑴条件2中试剂为 。
⑵写出苯甲醛与新制Cu(OH)2浊液反应的化学方程式 。
⑶苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式 。
31、(8分)碳正离子[例如CH3+、CH5+、(CH3)3C+]是有机反应的重要中间体。欧拉(G.Olah)因在此领域中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通达CH4在‘超强酸’中再获得一个H+而得到,而CH5+失去H2可以得CH3+
⑴CH3+是反应性很强的正离子,是缺电子的,其电子式是___________________
⑵CH3+中4个原子是共平面的,3个C-H键之间的夹角(键角)相等,则C-H键之间的夹角是___________
⑶(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式为________
⑷(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式为____________________
32、(10分)I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法如加入银氨溶液替代“闻生成物的气味”来检验,写出该化学方法的化学反应方程式 。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单易操作的实验,探究哪一种猜想正确? (写出使用的试剂、现象,结论的要点)
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约l min后鼓入空气。请填写下列空白:(3)乙醇发生催化氧化的化学反应方程式为
。
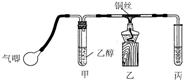 (4)实验时,常常将甲装置浸在70℃~80℃的水浴中,由于装置设计上的缺陷,实验进行时可能会产生
____________不良现象。
(4)实验时,常常将甲装置浸在70℃~80℃的水浴中,由于装置设计上的缺陷,实验进行时可能会产生
____________不良现象。
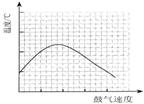 (5)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:
。
(5)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:
。
三、计算题(14分)
33、(5分)用铜片、锌片和3L稀H2SO4 组成原电池,若铜片上共放出3.36L气体(标准状况)时,H2SO4恰好全部作用完。试计算:⑴产生这些气体所消耗的锌的质量。⑵稀硫酸溶液的PH值?
34、(9分)有一元羧酸和一元醇形成的酯A。燃烧0.1molA,可得到5.4gH2O和6.72LCO2(标准状况)。3.7g A与100mL某浓度NaOH溶液共热,当完全水解后,为中和剩余的NaOH,需消耗0.5 mol·L-1盐酸60mL。求:
⑴A的分子式。
⑵A在酸性条件下水解后的两种产物的相对分子质量相等,写出A的结构简式。
⑶NaOH溶液的物质的量浓度。
 义乌四中高二化学测试答题卷2007.5
义乌四中高二化学测试答题卷2007.5
28、(1) (2) 29、 和 _________
30、(1)
(2) (3)________________
31、(1) (2)
(3) (4)
32、(1)
(2)
(3) (4)
(5)______________ ______
33、
34、
一、选择题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | A | A | B | C | D | C | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | B | B | C | A | B | A | C | A |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 |
|
|
|
| 答案 | B | A | C | A | C | D | C |
|
|
|
28、(1)正向 (2)B D
29、 NaOH 和 AlCl3
30、⑴ NaOH溶液 。
⑵ C6H5-CHO+2 Cu(OH)2→C6H5-COOH+Cu2O↓+2H2O 。
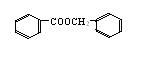 ⑶
⑶
31、⑴[![]() ]+
⑵120 ⑶(CH3)2CHOH ⑷(CH3)2CH=CH2
]+
⑵120 ⑶(CH3)2CHOH ⑷(CH3)2CH=CH2
32、Ⅰ⑴![]()
![]()
⑵用pH试纸检测溴水与褪色后溶液的酸碱性。若酸性明显增强,则猜想①正确;反之,猜想②正确(或其它合理方法)
Ⅱ.
![]() ⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑵ 发生倒吸
⑶过量的气体将体系中的热量带走
33、⑴ 9.75g ⑵ 1
34、⑴C3H6O2 ⑵HCOOCH2CH3 ⑶0.8 mol·L-1