高二化学下册第二月月考试题
一、单项选择题(本题包括8小题,每小题4分共32分。每小题只是一个选项符合题意)
1、在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量大
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
2、室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
3、已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI
4、25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7。若x=![]() y,则x值为
y,则x值为
A.2 B.3 C.4 D.5
5、将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)> c(A-)> c(H+)> c(OH-)
6、已知某温度下,在100 mL浓度为0.01 mol/L的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是
A.溶液的pH=2 B.c(Na+)=0.01 mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
7、已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃ B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
8、今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a+b=0.2mol/L
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9、将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若V1>V2,则将两种酸溶液稀释相同倍数,HA溶液的pH大于HB溶液的pH
10、某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是
A.若溶液中c(A—)= c(Na+),则溶液一定呈中性
B.溶液中不可能存在c(Na+)> c(A—)> c(OH—)> c(H+)
C.若c(OH—)> c(H+),溶液中不可能存在
c(Na’)> c(OH—)> c(A—)> c(H+)
D.若溶质为NaA、HA,则一定存在c(A—)> c(Na+)> c(H+)> c(OH—)
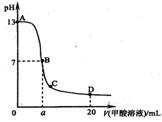 11、在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
11、在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如下图
所示,有关粒子浓度大小关系正确的是
A.在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+)
B.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
C.在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+)
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
12、下列叙述正确的是
A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合:
c(Na+)+c(H+) = 2c(CO32-)+c(OH-)
B.某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-![]() H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
H++A2-则NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
C.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.常温下,10 mL pH=12的Ba(OH)2溶液与40 mLcmol·L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50 mL,则溶液pH=11
13、人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
![]()
![]() H++HCO3+ H2CO3 CO2+H2O
H++HCO3+ H2CO3 CO2+H2O
![]()
![]() H++PO43- HPO42- H++HPO42- H2PO4-
H++PO43- HPO42- H++HPO42- H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是:
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小。
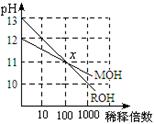 14、MOH和ROH两种一元碱的溶液分别加水稀释时,pH
14、MOH和ROH两种一元碱的溶液分别加水稀释时,pH
变化如右图所示。下列叙述中不正确的是
A.MOH是一种弱碱
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH) =10 c(MOH)
15、常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。
下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C、同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
16、已知:反应H2A+B-(足量)=HA-+HB和H2A+2C-(足量)=2HC+A2-,则下列说法正确的是
A、若将pH=3的H2A的溶液和pH=11的NaOH溶液等体积混合,则溶液呈酸性
B、HA-、B-、C-、A2-得质子能力由强到弱得顺序为C->A2->B->HA-
C、HC和B-间可发生反应:HC+B-=HB+C-
D、物质的量浓度均为1mol·L-1的HB溶液和NaOH溶液等体积混合后,溶液呈酸性
答 题 卷
班级_________姓名_____________学号________得分______________
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
![]()
二、不定项选择题(本题包括12小题,每小题4分,共48分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
![]()
三、(本题包括2小题)
17、(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。则该溶液
呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
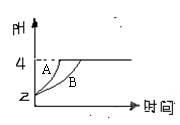
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向
其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如右图所示。则图中表示醋酸溶液中pH变化曲线的是
(填“A”或“B”)。设盐酸中加入的Zn质量
为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2
(选填“<”、“=”、“>”)
18、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(6)根据上述各数据,计算烧碱的纯度 。
四、(本题包括2小题)
19、工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,理由是 现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有 (有几个选几个填代号)
A.浓HN3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A. NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
20、蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
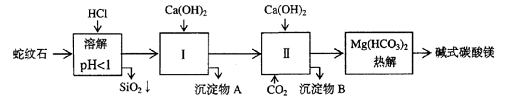
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了
Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8
(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_____________。
(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③_________________④__________________⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ C =_________
五、(本题包括2小题)
21、(7分)右图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
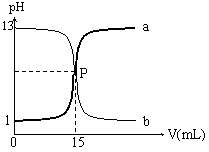 (1) 曲线a是用 溶液滴定 溶液;
(1) 曲线a是用 溶液滴定 溶液;
曲线b是用 溶液滴定 溶液;
(2) P点的坐标为( );
(3) 盐酸的物质的量浓度为 mol/L;
氢氧化钠溶液的体积为 mL。
22、(8分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
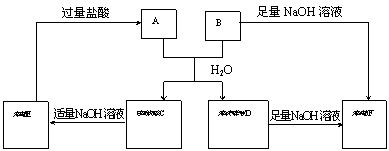 |
(1)无色溶液F中,一定含有的溶质的化学式为____。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________________。
(3)A和B的混合物溶于水发生反应的离子方程式____________________________。
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式_________________________________________________________。
六、(本题包括2小题)
23、(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-)(填“大于”、“等于”或“小于”)。
(3)如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为_______________。
(4) 常温下,若NaOH溶液中的c(OH―)与NH4Cl 溶液中的c(H+)相同,现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH 和 NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+pH2为 (可以用“>”、“=”或“<”表示)。
24、在相同条件下进行Mg和酸反应的对应实验,相关数据如下:
| Mg的质量 | 酸量 | 开始的反应速率 | 产生 H2总量 | |
| Ⅰ | 0.24g | HC1 0.2mol/L100mL | v1 | n1 |
| Ⅱ | 0.24g | CH3COOH 0.2mol/L100mL | v2 | n2 |
(1)试比较有关量的大小:v1______ v2、nl _______n2(填“>”“=”“<”)
(2)现欲改变条件,使实验Ⅰ中v1降低,但不改变nl的值,试写出两种可行的方法:
①_____________________________②______________________________
七、(本题包括2小题)
25、常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时消耗NaOH溶液13ml,试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
26、由HCl、MgCl2、AlCl3组成的混合溶液1.0L,其中c(HCl)=0.1mol/L,c(MgCl2)=0.1mol/L,c(AlCl3)=1.2mol/L。
⑴已知溶液中c(Mg2+)与溶液的PH的关系为lgc(Mg2+)=17—2×PH,向混合溶液中加入NaOH固体至PH=9,是否有Mg(OH)2沉淀生成? (填“是或否”)(不考虑NaOH的加入引起的体积变化,下同),原因是
⑵向混合溶液中加入NaOH固体,溶液中c(AlO2—)随PH的变化如下:
| PH | 8 | 9 | 10 | 11 |
| c(AlO2—)/mol·L—1 | 10—3 | 10—2 | 10—1 | 1 |
试写出在碱性条件下,c(AlO2—)与PH的关系式:
⑶向混合溶液中加入NaOH固体至PH=11,需要NaOH的质量为多少?(当溶液中某离子的浓度≤1×10—5mol/L时,可视为该离子完全沉淀。)(写出计算过程)。
答 案
1、C 2、D 3、C 4、B 5、A 6、B 7、D 8、A
9、AD 10 、A 11、D 12、D 13 、C 14、 D 15、AB 16 、AB
17、(1)碱; 向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确。(其他试剂合理也给分)
(2)B;<
18、(1)天平、小烧杯、药匙等
(2)小烧杯、玻璃棒、250mL容量瓶、胶头滴管
(3)碱式滴定管
(4)左,活塞,右,锥形瓶中溶液的颜色的变化
(5)0.4020mol/L
19、(1)不能,Fe2+沉淀的pH值最大,Fe2+沉淀完全时,Cu2+也沉淀
①A ②不妥当,引进Na+杂质,CDE
(2)CEF
20、 (1)Fe3+ Al3+ (2)Al(OH) 3、Mg(OH)2 (3)NaOH 过滤、洗涤、灼烧 (4)CO2
(5) ③测出CO2的质量 ④测出水蒸汽的质量 (6)3、1、3
21、(1) NaOH、盐酸;盐酸,NaOH;(2) (15,7);(3) 0.1 mol/L;15 mL
22、(1)Na2CO3 (2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)有白色胶状沉淀 AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
23、(1)D (2) <
(3) c(Cl-)= c(Na+) > c(H+)>c(CH3COO-)>c(OH-)
(4) pH1+pH2<14
24、⑴ > = ⑵①加水稀释 ②加入少量醋酸钠固体
25、⑴ C(NaOH)=0.04mol/L ⑵C(弱酸)=0.026mol/L (3)K=4×10-5
26、⑴否;当PH=9时代入,c(Mg2+)=0.1mol/L,浓度未变,则未形成Mg(OH)2沉淀。
⑵ —lgc(AlO2—)+PH=11
⑶196g