高二化学上周练练习题
班 姓名
可能用到的原子量: H-1 O-16 C-12 Al-27 Mg-24 Fe-56 Cu-64 Zn-65
1. 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能的是:
A.烧杯中有铜无铁 B.烧杯中铜、铁都有 C.烧杯中铜、铁都无 D.烧杯中有铁无铜
2. 下列有关金属元素特征的叙述,正确的是:
A.金属元素的原子只有还原性,离子只有氧化性B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中化合价均不同 D.金属元素所有单质在常温下均为固体
3. 关于烷烃性质的叙述,错误的是:
A.都能使酸性高锰酸钾溶液褪色 B.都能燃烧
C.都不溶于水 D.都能发生取代反应
4. 将金属钠投入氯化铝溶液中,下列有关叙述一定正确的是:
A. 一定有气体放出
B. 最后一定有沉淀生成,且有气体放出
C. 一定有金属铝析出
D. 溶液最后不一定澄清,但有气体放出
5. 将固体NH4I置于密闭容器中,在某温度下发生下列反应:
NH4I(s)![]() NH3(g)+HI(g) 2HI(g)
NH3(g)+HI(g) 2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
当达到平衡时,C(H2)=1mol/L, C(HI)=8mol/L, 则NH3的浓度为:
A.10 mol/L B. 9 mol/L C. 8 mol/L D. 7mol/L
6.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是:
A.2NO2![]() N2O4(正反应为放热反应)B.C(固)+CO2
N2O4(正反应为放热反应)B.C(固)+CO2![]() 2CO (正反应为吸热反应)
2CO (正反应为吸热反应)
C. N2+3H2![]() 2NH3 (正反应为放热反应)D.H2S
2NH3 (正反应为放热反应)D.H2S![]() H2+S(固)(正反应为吸热反应)
H2+S(固)(正反应为吸热反应)
7.硝酸亚铁溶液存在的主要平衡关系:Fe2++2H2O![]() Fe(OH)2+2H+,若加入盐酸则溶液的主要变化是:
Fe(OH)2+2H+,若加入盐酸则溶液的主要变化是:
A. 变黄 B. 变浅 C. 绿色加深 D. 无明显变化
8.下列各组离子中,能在溶液中大量共存,且当加入足量NaOH溶液后既产生沉淀又放出气体的一组是:
A.NO3-、Cl-、NH4+、Ba2+ B. NO3-、NH4+、Mg2+、SO42-
C.HCO3-、K+、Ca2+、NO3- D.Cl-、SCN-、Fe3+、NH4+
9.向1mol/LAlCl3溶液10mL中加入1mol/L的NaOH溶液,得到沉淀0.26g,则所加NaOH溶液的体积可能是:
A. 10mL、20mL B. 20mL、30mL C. 10mL、36.7mL D.20mL、36.7mL
10. 某气态烷烃和炔烃混合物1L,完全燃烧生成CO21.4L,水蒸气1.6L(同温、同压),该混合烃可能是:
A.甲烷和乙炔 B.甲烷和丙炔 C.乙烷和乙炔
D.无法确定
11. 镁、铝、铁三种金属,分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量
相等。则下列说法正确的是:
A. 消耗的三种金属的物质的量相等
B. 三种金属可能都过量
C. 消耗的三种金属的质量相等
D. 三种金属一定都过量
12.将体积都为10mL、pH都等于3的醋酸和盐酸,分别加水稀释至amL和bmL,测得稀释溶液的PH值均为4,则稀释后溶液的体积:
A. a=b=100mL B. a=b=1000mL C. a<b=100mL D. a>b=100mL
13. 在催化剂存在下,将aL乙炔和乙烯的混合气体与足量H2发生加成反应,消耗H21.25aL,则混合气体中乙炔与乙烯的物质的量之比是:
A. 1:4 B. 1:2 C. 1:1 D. 1: 3
14.无论怎样调整用量都只能得到一种产物的是:
A. Al2(SO4)3溶液中加入NaOH溶液 B. Na2CO3溶液中滴加HCl溶液
C. H2SO4溶液和Ba(OH)2溶液
D. NaAlO2和HCl溶液反应
15.下列叙述中不正确的是
A.C60与石墨是同素异形体 B.H(氕)、D(氘)T(氚)互为同位素
C.甲烷和戊烷是同系物 D.2-甲基丁烷与丁烷互为同分异构体
16. 适量的铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是:
A. 2:3 B. 3:2 C. 1:2 D. 1:1
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17. 在一定条件下可实现下图所示的物质之间的变化。其中B是一种氧化物,D是A中的一种成分。
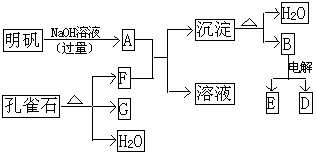
⑴ 孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解。图中的F是 ;
⑵写出明矾溶液和过量NaOH溶液反应的离子方程式
;
⑶图中B经电解得到的一种金属单质可以跟G在高温下反应,写出该反应的方程式
。
18. 某烃2.8g在氧气中燃烧生成8.8g CO2和3.6g H2O,在标准状况下其密度为2.5g/L,求其分子式?已知该烃可以使溴水褪色,使写出符合要求的所有结构简式。
答案
1.D 2.B 3.A 4.AD 5.A 6.B 7.A 8.B 9.C 10.A 11.B 12.D 13.D 14.C
15.D 16.A
17. ⑴CO2;⑵Al3++4OH-=AlO- 2 +2H2O;⑶2Al+3CuO △=== Al2O3+3Cu
18. 该烃分子式为: C4H8
结构简式为:CH2=CH-CH2-CH3 CH3-CH=CH-CH3 CH2=C(CH3)-CH3